_8 Технологии редактирования генов (GET) могут вызывать нокдаун генов или нокаут генов для биомедицинских применений. Клинический успех молчания генов с помощью терапии RNAi привлекает внимание к другим GET как терапевтическим подходам. Целью этого обзора является освещение GET, категорий, механизмов, проблем, текущего использования и перспективных применений. При подготовке этого обзора с акцентом на фундаментальные соображения использовались различные академические поисковые системы, электронные базы данных и библиографии избранных статей. Представленные результаты показали, что среди GET CRISPR/Cas9 обладает более высокой эффективностью редактирования и специфичностью нацеливания по сравнению с другими GET для вставки, удаления, модификации или замены гена в определенном месте генома хозяина. Таким образом, CRISPR/Cas9 отлично подходит для молекулярной, тканевой, клеточной и органной терапии. Следовательно, GET могут быть использованы для открытия инновационных методов лечения генетических заболеваний, пандемий, рака, безнадежных заболеваний и недостаточности органов. В частности, GET использовались для производства генно-модифицированных животных, чтобы избежать отказа органов человека. Генетически модифицированные свиньи используются в клинических испытаниях в качестве источника сердца, печени, почек и легких для ксенотрансплантации (XT) у людей . Вирусные, невирусные и гибридные векторы использовались для доставки GET с некоторыми ограничениями. Таким образом, внеклеточные везикулы (ВВ) предлагаются в качестве интеллектуальных и будущих грузов для доставки GET в клинических приложениях. Это исследование пришло к выводу, что GET перспективны для производства молекулярной, клеточной и органной терапии. Использование GET в качестве XT также все еще находится на ранней стадии, и у них есть проблемы с этикой и биобезопасностью.
Несмотря на успех препаратов на основе GET, они гидролизуются нуклеазами, иммуногенны и не могут легко проникать в биомембраны из-за присутствия полианионных доменов [5]. Помимо этого, основными ограничениями GET являются их быстрое выведение почками и нецелевые эффекты [21]. Поэтому химические модификации предлагаются в качестве подхода к разработке устойчивых к нуклеазам GET. Более того, для достижения достаточной доставки этих векторов во внутриклеточную среду необходимо использование интеллектуальных векторов доставки [45]. Следовательно, исследователи доставки лекарств сосредоточились на разработке векторов доставки для доставки GET к их внутриклеточным местам [46]. Систему доставки можно использовать для улучшения клеточного поглощения препаратов GET [29], а также для улучшения их стабильности и внутриклеточной доставки [34]. В связи с этим природные и синтетические полимеры используются для изготовления грузов, доставляющих молчание генов, для повышения их эффективности и безопасности в клинических целях [21,47]. В частности, катионные полимеры предлагаются в качестве систем доставки GET, эти полимеры доступны по цене, могут быть изготовлены, биоразлагаемы, имеют пролонгированную циркуляцию и регулируются для достижения желаемого пункта назначения [20]. С химической точки зрения катионные полимеры заряжены положительно и могут взаимодействовать с отрицательно заряженными молекулами, редактирующими гены, с образованием наноматериалов. Эти грузы могут преодолевать биологические барьеры и модулировать экспрессию генов [20]. Более того, катионные полимеры могут быть созданы для доставки их груза в определенные клетки, ткани или органы [15]. В совокупности такие полимеры, как хитозан, желатин и другие, в наномасштабе являются биоразлагаемыми и могут быть использованы для доставки ГЭТ для таргетной терапии. Кроме того, для доставки GET использовались липосомы и проникающие в клетку пептиды [48]. Кроме того, наночастицы на основе липидов могут доставлять GET во внутриклеточную среду [49]. Более того, векторы доставки GET расширены за счет включения клеток, внеклеточных везикул (ВВ), вирусных векторов и бактериальных везикул [50]. ВВ, такие как экзосомы, микровезикулы, микрочастицы, эктосомы, онкосомы, апоптотические тельца и многие другие термины, названы в соответствии с их клеточными источниками [51]. ЭВ функционируют как способ межклеточной передачи сигналов и молекулярного переноса, вызывая разнообразные биологические эффекты. Более того, ЭВ обладают врожденной способностью обходить биологические барьеры и транспортировать свои компоненты к клеткам-мишеням [52]. Обширные исследования показали, что ЭВ являются грузом для лекарств на основе РНК, а CRISPR/Cas9 модулирует экспрессию генов [53]. Кроме того, гибридные векторы могут быть собраны путем интеграции биологических и синтетических ингредиентов, чтобы представить инновационную модель систем доставки GET [46]. Сообщается, что эти векторы являются передовыми системами доставки, которые нацеливают терапевтические средства на ткани, клеточные и внутриклеточные компартменты печени, селезенки, легких, костного мозга, опухолевых клеток и других клеток [54].
_6_ нехватка доступных трансплантатов и долговременная дисфункция трансплантата остаются основными препятствиями для трансплантации органов. Изучение подходов к решению этих проблем является актуальным, и редактирование транскриптома на основе CRISPR/Cas9 предлагает одно из потенциальных решений. Кроме того, сочетание редактирования генов на основе CRISPR/Cas9 с системой перфузии органов ex vivo позволит осуществлять предимплантационное редактирование транскриптома трансплантатов. Как определить эффективные цели вмешательства, становится новой проблемой. К счастью, появление высокопроизводительного скрининга CRISPR значительно ускорило достижение эффективных целей. В этом обзоре обобщены текущие достижения, использование и рабочий процесс скрининга CRISPR в различных иммунных и неиммунных клетках. В нем также обсуждаются текущие применения редактирования генов на основе CRISPR/Cas при трансплантации и перспективные применения скрининга CRISPR при трансплантации твердых органов.
Система CRISPR/Cas9 представляет собой технологию редактирования генома третьего поколения, которая стала усовершенствованной заменой нуклеаз с цинковыми пальцами и эффекторных нуклеаз, подобных активаторам транскрипции, при редактировании генов благодаря своей повышенной простоте и точности ( 1 ). Системы CRISPR/Cas и их производные могут использоваться для отдельных генетических процедур и высокопроизводительных исследований, включая объединенный и групповой скрининг ( 2 ).
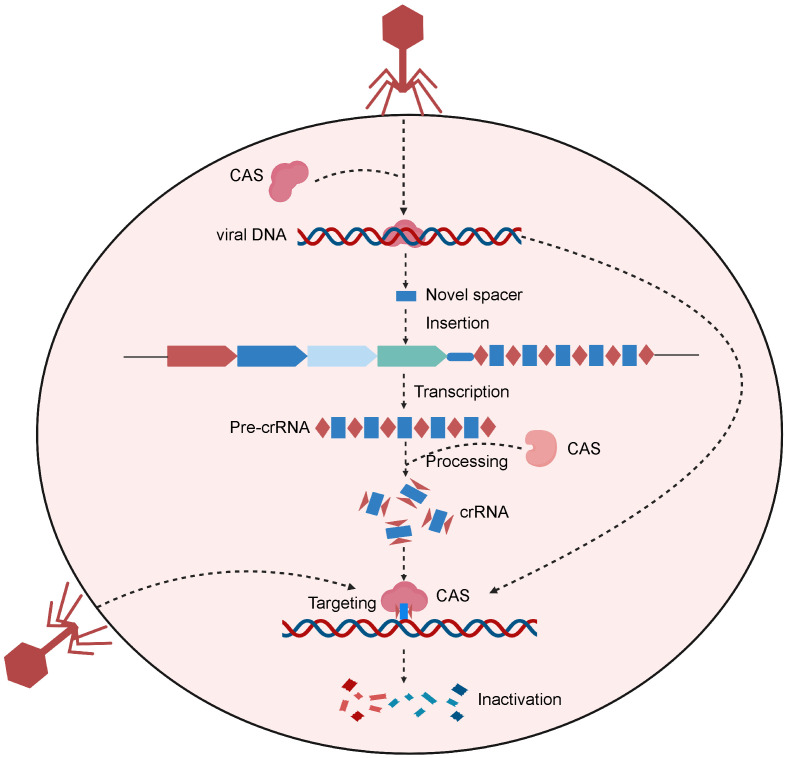
Система CRISPR/Cas — это тип естественной иммунной системы прокариот ( 34 ). CRISPR расшифровывается как «Кластеризованные регулярно расположенные короткие палиндромные повторы». Прокариоты используют этот механизм для противодействия вторжению вирусов и чужеродной ДНК ( 35 ) (Рисунок 1). При вирусной инвазии некоторые бактерии могут включать фрагмент вирусного гена в свою ДНК в определенной области, известной как пространство хранения CRISPR ( 36 ). При повторной встрече с вирусом бактерии инициируют транскрипцию CRISPR с образованием РНК-предшественника CRISPR (пре-crRNA), которая впоследствии подвергается процессингу с образованием crRNA, несущих последовательность, комплементарную чужеродным генам. Узнав последовательности, гомологичные вирусному гену, crРНК направляют нуклеазы Cas к связыванию и расщеплению целевого гена, защищая бактериального хозяина от вирусной инфильтрации ( 36 ).
…. сочетание метода CRISPR/Cas9 с системой перфузии органов ex vivo позволяет редактировать транскриптом трансплантатов перед имплантацией ( 12 , 13 ). Новой задачей становится выбор эффективных целей. К счастью, скрининг CRISPR облегчил идентификацию потенциальных терапевтических мишеней в иммунных и неиммунных клетках при различных заболеваниях, связанных с иммунитетом ( 5 ), предлагая новое понимание трансплантации.
…. Усиление эффекторной функции терапевтических клеток с помощью редактирования генома на основе CRISPR/Cas9 — потенциальное решение ( 20–22 ) . Кроме того, сочетание редактирования генов на основе CRISPR/Cas9 с системой перфузии органов ex vivo позволит осуществлять предимплантационное редактирование транскриптома трансплантатов ( 12 ).
На основании различий в последовательностях и структурах белков Cas системы CRISPR/Cas можно разделить на два класса и шесть типов ( 37 ). Система CRISPR/Cas класса 1 содержит многосубъединичный комплекс crRNA-эффектор, включая системы CRISPR/Cas типа I, типа III и типа IV ( 38 ). Однако система CRISPR-Cas класса 2, которая включает системы CRISPR/Cas типа I, типа III и типа IV, нуждается только в одной субъединице crRNA-эффекторного модуля ( 38 ). Подробное описание системы CRISPR/Cas представлено в Таблица 1. Будучи простым и гибким методом редактирования генома, система CRISPR/Cas произвела революцию в области биомедицинских исследований ( 39 ). Система CRISPR/Cas типа II возникла как простой и эффективный инструмент редактирования генома различных клеток и организмов ( 40 , 41 ), требующий всего лишь многофункционального белка Cas9 для вмешательства в вторжение генетических элементов ( 42 ). Система CRISPR типа II послужила основой для системы редактирования генов CRISPR/Cas9. Однако на эффективность системы CRISPR/Cas9 у эукариот влияет хромосомный статус сайта-мишени ( 6 ). Для эффективной доставки белка Cas9 в ядра млекопитающих его N- или C-конец сливают с эукариотическим сигналом ядерной локализации ( 43 ).
В заключение отметим, что система CRISPR/Cas9 уже вносит значительный вклад в функциональные геномные эксперименты и может оказать беспрецедентное влияние на экспериментальную биологию в будущем ( 55 ). Более того, он обладает огромным потенциалом для разнообразных применений генной терапии, включая заболевания крови, опухоли и другие генетические нарушения.
… Генетический скрининг — мощный инструмент для изучения генов, ответственных за разнообразные биологические фенотипы и заболевания. С развитием генетических инструментов появилось множество целевых методов, нацеленных на весь геном. Например, библиотеки РНКи обычно использовались для скрининга функций генов из-за их эффективности в снижении экспрессии генов на уровне мРНК ( 56 ).
CRISPOR.org — это веб-инструмент, разработанный специально для исследований по редактированию генома CRISPR/Cas9. Эта платформа идентифицирует гРНК во входной последовательности и использует различные показатели для их ранжирования, оценки их потенциала нецелевых эффектов в целевом геноме и прогнозирования их целевой активности ( 66 ). Недавние достижения в области CRISPOR включают разработку праймеров для секвенирования следующего поколения для оценки нецелевых мутаций, создание индивидуальных олигонуклеотидов для направляющего клонирования и стратегии пакетного проектирования для полногеномного скрининга CRISPR ( 66 ).
Браузер генома UCSC
Браузер генома Калифорнийского университета в Санта-Крусе (UCSC) предоставляет разнообразную информацию и инструменты, которые улучшают наше понимание геномного контекста многих видов. Это облегчает углубленный анализ данных и позволяет запрашивать интересующие регионы в различных наборах данных из нескольких источников ( 67 ). Кроме того, исследователи могут включать свои данные на основной дисплей, что облегчает запрос данных и обмен ими с другими ( 67 ). При проведении исследований по редактированию генома CRISPR/Cas9 можно выбрать из пула надежных последовательностей гРНК, ранее созданных путем сосредоточения внимания на конкретной целевой области гена ( 68 ).
4.1.3.4. Э-КРИСП
E-CRISP — это веб-приложение, разработанное для проектирования последовательностей геномной РНК, которое обеспечивает параметры проектирования, ориентированные на эксперименты, что позволяет создавать множество библиотек и систематически исследовать эффекты в различных условиях ( 69 ). E-CRISP идентифицирует целевые последовательности, которые комплементарны гРНК и заканчиваются мотивом, прилегающим к протоспейсеру (PAM), N(G) или A(G). Этот мотив необходим для того, чтобы нуклеаза Cas9 могла расщеплять двухцепочечную ДНК при активации ( 69 ). E-CRISP использует дерево двоичных интервалов для быстрого аннотирования потенциальных целевых положений гРНК и стратегию быстрой индексации для поиска сайтов связывания ( 69 ).
4.1.3.5. ОТБИВНАЯ КОТЛЕТА
CHOPCHOP — это веб-инструмент для идентификации целей sgRNA в системе CRISPR/Cas ( 70 ). Его руководящий принцип — предоставить доступный и мощный инструмент, который принесет пользу пользователям всех уровней, как новичкам, так и опытным ( 71 ). CHOPCHOP предоставляет различные расширенные возможности для выбора целей и учитывает различные входные данные, такие как идентификаторы генов, геномные области или вставленные последовательности ( 72 ). Он применяет эффективные методы выравнивания последовательностей для сокращения времени поиска и дублирования за счет точного прогнозирования нецелевого связывания sgRNA ( 72 ). Каждый запрос генерирует интерактивное представление гена, отображая потенциальные целевые сайты в их геномных местоположениях с цветовой кодировкой в зависимости от их рейтинга качества ( 72 ).
Таблица 6 Терапевтические мишени в иммунных клетках мышей идентифицированы с помощью скрининга CRISPR.
…
Двадцать процентов реципиентов потеряют взятку в течение пяти лет, а 50% — в течение 10–12 лет ( 220 ). Отторжение аллотрансплантатов, в первую очередь регулируемое иммунной системой, представляет собой центральную проблему долгосрочного выживания трансплантатов. Взаимодействие между врожденной и адаптивной иммунной системой, опосредованное различными иммунными клетками, представляет собой ключевой компонент отторжения аллотрансплантатов ( 221 , 222 ). Более того, эти иммунные клетки могут вызывать более сильное иммунологическое отторжение при ксенотрансплантации. В последние годы ряд исследований был сосредоточен на редактировании генома CRISPR иммунных клеток реципиентов.
Во-первых, Treg продемонстрировали значительный потенциал в АКТ благодаря их осуществимости, переносимости и потенциальной эффективности ( 165 ). Более того, Treg являются основными клетками-мишенями для установления толерантности к трансплантату ( 223 ). До сих пор было доказано, что Treg-терапия является безопасным терапевтическим методом ( 224 ). Важно свести к минимуму заболеваемость и смертность среди реципиентов трансплантатов паренхиматозных органов и снизить потребность в паниммуносупрессивных препаратах ( 19 ). Первое применение Treg-терапии было при РТПХ, и ее терапевтический эффект был продемонстрирован на данных доклинических моделей ( 165 ). В последние годы все больше и больше исследований используют технологию CRISPR для изменения иммуномодулирующей функции Treg ( 225 ). В 2016 году Левингс и др. создали A2-CAR (HLA-A2-специфический CAR), который заметно усилил терапевтический потенциал Treg при трансплантации с использованием технологии CAR ( 225 ). Кроме того, в 2017 году Йошимура и др. отредактировали ген Foxp3 в первичных Т-клетках мышей с помощью CRISPR/dCas9 ( 21 ). Более того, в 2019 г. Хорват и др. использовали активатор транскрипции dCas9 на основе слияния доменов активатора для достижения продолжительной экспрессии FOXP3 в клетках Jurkat ( 22 ).
Помимо Treg, еще одной потенциальной мишенью редактирования генов для иммунной толерантности при трансплантации органов являются дендритные клетки (ДК). В 2019 году Ван и др. использовали наномедицинскую технологию на основе CRISPR/Cas9, чтобы непосредственно вызвать дефицит CD40 в ДК in vitro и in vivo ( 226 ). Они успешно оказали защитное воздействие на выживаемость трансплантата, регулируя активацию Т-клеток.
В заключение отметим, что технология редактирования генома CRISPR может стать потенциальным способом точного и эффективного вмешательства в функцию иммунных клеток реципиентов органов.
Рак — это генетическое заболевание, вызванное кумулятивными генетическими/эпигенетическими аберрациями ( 204 ). Важной характеристикой рака является уклонение от иммунитета, в первую очередь регулируемое контрольными точками ( 205 ), что представляет собой существенное препятствие для терапии рака. К счастью, мы можем точно идентифицировать гены-кандидаты, мутация которых вызывает рак, с помощью скрининга CRISPR, что позволяет нам исследовать подходящие мишени для лекарств и помогает нам понять геномику рака ( 52 ). Мы суммировали текущие применения скрининга CRISPR в раковых клетках и представили обобщение вТаблица 7.
Было доказано, что предимплантационная модуляция транскриптома в аллотрансплантатах или ксенотрансплантатах является потенциальным способом расширения пула доноров при трансплантации паренхиматозных органов ( 229 , 230 ).
Модуляция транскриптома.
В 2023 году Кешавджи и др. использовали технологии CRISPR/Cas для усиления экспрессии IL10 в донорских легких и трансплантировали его крысам-реципиентам ( 231 ). Кроме того, клеточные линии человека и крысы были протестированы на эффективность, титруемость и мультиплексность ( 231 ). Это исследование доказало возможность предимплантационной модуляции транскриптома с использованием технологии CRISPR для расширения пула доноров и улучшения результатов трансплантации.
_6
Проблемы технологии CRISPR при трансплантации твердых органов
Во-первых, доставка Cas9 к определенным типам клеток часто ограничивается низкой эффективностью трансфекции и трансдукции, особенно в первичных иммунных клетках и in vivo ( 243 ). На данный момент электропорация может быть потенциальным способом решения этой проблемы. Кроме того, при скрининге на нокаут CRISPR некоторые поврежденные клетки могут сохранять функцию целевого белка благодаря внутрикадровому редактированию ( 244 ). Кроме того, проверка редактирования отдельных ячеек обычно невозможна, что увеличивает шумовые сигналы экрана. Нецелевые эффекты также являются серьезной потенциальной проблемой при редактировании генома CRISPR ( 245 ). Неправильное связывание гРНК приведет к нежелательным нецелевым мутациям, что потенциально может привести к нестабильности генома и нарушению нормальных функций генов. Редактирование генома CRISPR/Cas9 также может привести к массовой потере оснований, что потенциально является более серьезным исходом, чем нецелевые эффекты ( 246 ). Более того, целевой мутагенез в двухцепочечных разрывах, вызванных однонаправленной РНК/Cas9, может приводить к долгосрочным транскрипционным и патогенным последствиям ( 247 ). Поиск эффективных инструментов, которые могут обеспечить более точное редактирование генома, является актуальным в области редактирования генома CRISPR.
Более того, иммунный ответ является еще одной серьезной проблемой при редактировании генома CRISPR. ГРНК и ДНК-плазмиды могут активировать рецепторы распознавания образов, которые чувствуют чужеродные нуклеиновые кислоты. Например, трифосфатная группа на 5′-конце гРНК в рибонуклеопротеиновом комплексе (РНП) может распознаваться рецептором RIG-I как чужеродная вирусная РНК, индуцируя IFN-опосредованный иммунный ответ типа I, который опосредует цитотоксический эффект. 248 , 249 ). Более того, аденовирусные векторы также могут вызывать воспалительную реакцию, препятствуя развитию вмешательства в геном in vivo ( 250–252 ). Таким образом, безопасные и эффективные системы доставки актуальны для терапевтического редактирования генома при трансплантации.
——- Возможные перспективные направления применения данной технологии изложены в обзоре 6.
_19_ В этой работе мы описываем применение целых эксплантатов печени человека в нормотермической перфузионной системе ex situ для оценки набора из четырнадцати природных и биоинженерных векторов аденоассоциированных вирусов (ААВ) непосредственно в печени человека, в присутствии и в отсутствие нейтрализующих агентов человека. сэра. В ненейтрализующих условиях недавно разработанные варианты AAV, AAV-SYD12 и AAV-LK03, оказались наиболее функциональными вариантами с точки зрения клеточного поглощения и экспрессии трансгена. … По мере того, как мы продвигаемся дальше в эпоху персонализированной медицины, проблема разработки клинически прогностических модельных систем для оценки технологий переноса генов и редактирования генов представляет собой серьезное препятствие. Идеальная модельная система должна не только точно имитировать физиологические состояния человека и сложную организацию тканей, но и надежно предсказывать клинические результаты. В мире генной терапии, направленной на печень, 2D и 3D модели in vitro, включая органоиды, полученные из индуцированных плюрипотентных стволовых клеток (iPSC), мышиные модели, включая модели ксенотрансплантатов, и приматов, не являющихся человеком, традиционно использовались для разработки и проверки новых передовых терапевтических средств. . Однако, учитывая тот факт, что печень является сложным органом, состоящим из нескольких типов клеток, которые вносят вклад в уникальную структурную и функциональную организацию, сложность человеческой печени оказалось трудно переосмыслить. В ответ на этот вопрос, особенно в отношении терапии на основе аденоассоциированных вирусных (AAV) векторов, нацеленной на печень, мы представляем разработку доклинической модели, основанной на целых эксплантатах печени человека, хранящихся в нормотермической (36 °C) перфузии ex situ. система. Эта модель обеспечивает платформу, которая позволила нам впервые, насколько нам известно, оценить функциональность существующих и дополнительных рекомбинантных аденоассоциированных вирусных (rAAV) векторов непосредственно в печени человека.
Литература Редактирование генов при НМП