_2_ Трансплантация мезенхимальных стволовых клеток (МСК) является еще одним многообещающим подходом к улучшению качества краевых донорских сердец [ 85 , 86 , 87 ]
_9 Благодаря своим противовоспалительным и иммуномодулирующим свойствам мезенхимальные стволовые клетки являются одними из наиболее многообещающих источников терапии острой и хронической печеночной недостаточности, но их обычное клиническое применение ограничено рядом проблем биобезопасности. Выясняется, что динамическая консервация и терапия стволовыми клетками могут дополнять друг друга, если их сочетать, поскольку машинная перфузия может использоваться для доставки стволовых клеток к сильно поврежденным трансплантатам, избегая потенциальных системных побочных эффектов.
Несмотря на большие успехи МП в улучшении сохранности и использования трансплантатов печени, определенный процент органов по-прежнему считается слишком поврежденным для трансплантации. Таким образом, инновационные подходы, направленные на восстановление сильно поврежденных органов, могут еще больше увеличить количество доступных трансплантатов и позволить проводить ТП пациентам, которым ТП могла бы помочь, но в настоящее время исключена из-за нехватки органов.
Благодаря своему противовоспалительному и иммуномодулирующему действию мезенхимальные стволовые клетки (МСК) могут представлять собой один из таких подходов. МСК являются одними из наиболее широко изученных типов клеток [ 13 ] и были протестированы при различных заболеваниях, от острой печеночной недостаточности до инфаркта миокарда и мозга [ 14 , 15 ]. Благодаря своей мультипотентности МСК способны мигрировать к поврежденным участкам и способствовать восстановлению тканей либо путем длительного приживления и дифференцировки, либо, что наиболее важно, с помощью паракринных механизмов [ 14 , 15 ]. Действительно, МСК секретируют большое разнообразие факторов роста, цитокинов и внеклеточных везикул (ВВ), которые являются важными медиаторами межклеточной коммуникации и могут модулировать фенотип и поведение своих мишеней, являясь наиболее ответственными участниками биологических реакций, связанных с администрации MSC [ 15 ]. При ТП МСК привлекают внимание в связи с возможностью снижения IRI и индуцирования толерантности к трансплантату, однако их рутинное применение затруднено из-за короткой выживаемости клеток, значительных высоких доз, необходимых для получения ощутимого биологического эффекта, неспецифического биораспределения и риска нежелательных явлений. [ 16 ].
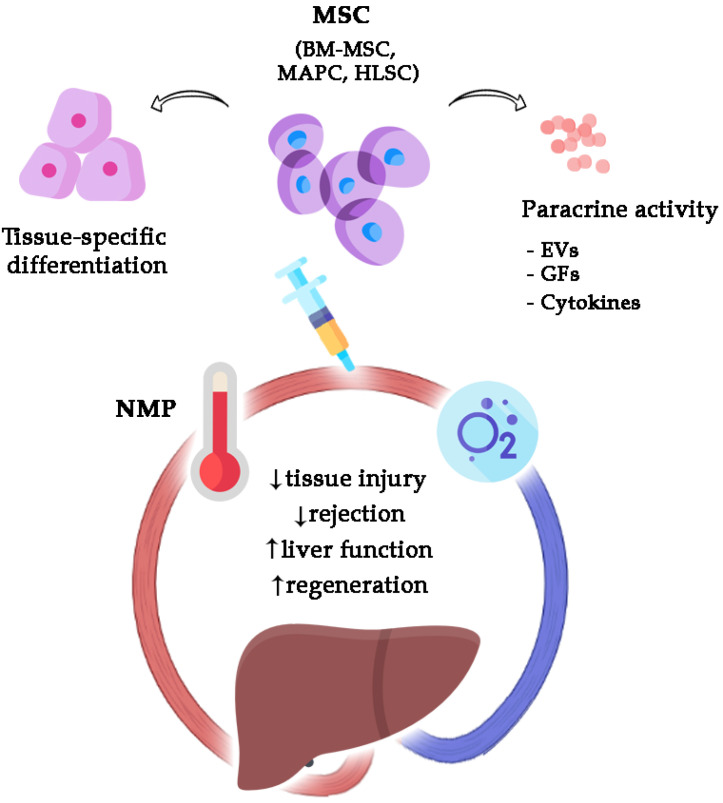
Учитывая текущий прогресс в динамической консервации органов, становится очевидным, что МП может служить платформой для введения МСК в поврежденные органы, избегая при этом ошибок системного введения (Рисунок 1). Несмотря на то, что этот комбинированный подход все еще находится на доклинической стадии, важные вехи уже достигнуты в восстановлении печени, легких и почек, что привело к переходу от моделей на грызунах к моделям большого размера [ 17 ].
В области регенеративной медицины МСК являются одним из наиболее широко изученных типов клеток: проводится более 1000 исследований, изучающих их потенциальное клиническое применение [ 40 ]. Учитывая растущий интерес к МСК как потенциальным средствам лечения ряда заболеваний человека и, как следствие, необходимость стандартизации протоколов производства, было предложено универсальное определение МСК со следующими критериями [ 41 ]: (1) приверженность пластику, (2) специфичность экспрессия поверхностного антигена (положительная для CD105, CD73 и CD9 и отрицательная для CD45, CD34, CD14 или CD11b, CD79a или CD19 и HLA класса II) и (3) потенциал мультипотентной дифференцировки в остеобласты, адипоциты и хондробласты in vitro.
Хотя точный механизм их функции все еще остается предметом исследований, выяснилось, что МСК играют важную иммуномодулирующую и регенеративную роль посредством активации паракринных механизмов [ 42 ]. Более конкретно, МСК могут модулировать воспаление и способствовать восстановлению тканей, высвобождая цитокины, факторы роста и внеклеточные везикулы (ВВ), которые усиливают эндогенные реакции на повреждение [ 43 ]. Восстановление тканей также опосредовано способностью МСК генерировать дифференцированные функционирующие клетки, которые могут непосредственно заселять поврежденный участок, как в случае гепатоцитоподобных клеток, происходящих из МСК [ 44 , 45 , 46 ].
При заболеваниях печени благотворное влияние МСК было продемонстрировано в большом количестве доклинических исследований, в которых изучалось их влияние как на моделях острых, так и на хронических заболеваниях [ 46 , 47 , 48 , 49 , 50 , 51 ], что в конечном итоге привело к их назначение людям, страдающим циррозом печени и печеночной недостаточностью [ 52 ] (Таблица 2).
В 2006 году Эррера и др. выделили мультипотентную клеточную линию из печени взрослого человека, названную стволовыми клетками печени взрослого человека (HLSC) [ 53 ]. HLSC экспрессировали типичные маркеры MSC (CD29, CD73, CD44 и CD90) и маркеры стволовых клеток (виментин и нестин), но не маркеры гемопоэтических стволовых клеток (CD34, CD45, CD117 и CD133) и были частично коммитированы в печеночную линию, как поддерживается экспрессией альбумина, альфа-фетопротеина и, в небольшом проценте клеток, цитокератина-8 и цитокератина-18 [ 53 ]. Более того, HLSCs дифференцировались в зрелые гепатоциты при культивировании в специфических условиях культивирования [ 53 , 54 ] и проявляли иммуномодулирующие свойства [ 55 ]. На сегодняшний день несколько исследований повреждений печени на животных подтвердили регенеративный потенциал HLSC [ 56 , 57 , 58 ], а первое применение у человека привело к их безопасному внутрипеченочному введению младенцам с наследственной неонатальной гипераммониемией [ 59 ].
Как упоминалось ранее, появляется все больше доказательств того, что влияние МСК в основном зависит от их секретома, а не от их дифференцировки в клетки-мишени [ 42 ]. На этом основании многие группы сосредоточились на разработке бесклеточных подходов, чтобы потенциально избежать некоторых ограничений терапии на основе стволовых клеток, таких как доступность, плохой потенциал приживления, иммунное отторжение и риск злокачественной трансформации [ 60 ].
Кондиционированная среда, полученная из МСК (MSC-CM), содержит большое количество цитокинов и паракринных факторов, которые оказывают сравнимый эффект с терапией на основе МСК. Фактически, MSC-CM были способны ослаблять воспаление, апоптоз и некроз, одновременно способствуя пролиферации клеток в различных моделях острого повреждения печени [ 61 , 62 ]. Более того, MSC-CM эффективно улучшали функцию митохондрий и резистентность к инсулину, а также уменьшали отложение коллагена у мышей с хронической моделью неалкогольной жировой болезни печени и холестатического фиброза соответственно [ 63 , 64 ]. Однако большинство биологических эффектов MSC-CM опосредованы содержащимися в нем ЭМ.
ЭВ представляют собой гетерогенную группу покрытых мембраной структур разного размера и разного происхождения, которые высвобождаются практически из всех типов клеток [ 65 ]. Они действуют как паракринные факторы, неся различные функциональные молекулы, преимущественно белки и РНК, которые могут выявить состояние родительских клеток и способствовать межклеточной коммуникации как при физиологических, так и при патологических состояниях. Эти характеристики побудили использовать ЭВ в качестве диагностических маркеров и терапевтических мишеней, а также, учитывая, что по сравнению с МСК их легче хранить и вводить, они действуют более похоже на лекарство, чем на клеточную терапию [ 66 ] . ЭВ можно разделить по размеру на (1) экзосомы (диаметром 30–150 нм), которые высвобождаются в результате слияния мультивезикулярных телец с плазматической мембраной, (2) крупные ЭВ, такие как микровезикулы, также называемые везикулами внешней мембраны, эктосомами. или отслаивающиеся везикулы (диаметром от 100 до 1000 нм), которые образуются в результате отпочкования плазматической мембраны, и (3) апоптотические тельца, которые отпадают в процессе клеточного апоптоза (диаметр от 50 до 5000 нм) [ 65 , 67 ]. Более того, ЭВ также можно классифицировать на основе их содержания, биогенеза, функций или секреторного происхождения, и такое большое разнообразие подкатегорий ясно демонстрирует необходимость стандартизированных протоколов производства и характеристики, которые делают их терапевтическое использование осуществимым и воспроизводимым [ 68 ].
Исследования на животных показали, что при заболеваниях печени ЭВ, полученные из МСК (MSC-EV), могут ингибировать апоптоз, усиливать функцию гепатоцитов, способствовать ангиогенезу и пролиферации, а также снижать воспалительную реакцию на ИРИ [ 69 , 70 , 71 ], что делает их пригодными для лечения заболеваний печени. кандидаты на терапию не только при острых и хронических заболеваниях печени [ 72 ], но и при трансплантации. Аналогичные результаты были получены с EV, полученными из HLSC (HLSC-EV), которые, как было показано, способствуют регенерации печени у крыс, перенесших субтотальную гепатэктомию [ 73 ], ослабляют фиброз [ 74 ] и уменьшают IRI печени [ 75 ].
Привлекательные иммуномодулирующие и регенеративные эффекты МСК, а также возможность поддерживать метаболически «живую» печень вне организма человека с помощью NMP стимулировали идею доставки терапии стволовыми клетками непосредственно в перфузируемый трансплантат, используя практические преимущества и преимущества биобезопасности, предлагаемые этой уникальной платформой. (Таблица 3). Первые эксперименты, которые успешно доказали эту концепцию, были проведены на легких и почках, что привело к дальнейшим доклиническим исследованиям, которые подтвердили способность МСК и продуктов, полученных из МСК, восстанавливать почечную и легочную функцию во время МП [ 17 ].
Сасаджима и др. [ 76 ] были первыми, кто успешно восстановил печень крыс, полученную после сердечно-сосудистой смерти (DCD), с помощью MSC, введенных во время NMP. В их эксперименте введение стволовых клеток, полученных из жировой ткани свиней, в начале перфузии бескровным перфузатом было связано с увеличением выработки желчи и сохранением синусоидальной и гепатоцеллюлярной морфологии после 2 часов NMP.
На основании этих предварительных результатов группа из Тяньцзиня провела несколько экспериментов с использованием МСК костномозгового происхождения (BM-MSC) для восстановления печени крыс, подвергнутых 30-минутной тепловой ишемии перед NMP [ 77 , 78 , 79 , 80 , 81 , 82] . , 83 , 84 ]. Во всех этих исследованиях лечение было связано с меньшим выбросом трансаминаз в перфузат, увеличением выработки желчи и улучшением гистологии [ 77 , 78 , 79 ]. Интересно, что авторы предоставили последовательное механистическое объяснение этим защитным эффектам, показав, что BM-MSCs могут регулировать различные пути каскада IRI. Окислительный стресс, повреждение митохондрий и активация макрофагов, все ключевые элементы ишемического и раннего постреперфузионного ответа, были снижены в группах, получавших лечение, а также активация эндотелия и нарушение синусоидальной микроциркуляции, которые происходят во время поздней фазы ИРИ [ 77 , 78 ]. Более того, BM-MSCs подавляют высвобождение АФК и свободного Fe 2+ , что указывает на защитную роль против ферроптоза, типа запрограммированной гибели клеток, опосредованной железозависимым накоплением пероксидов липидов [ 79 ]. Многообещающий потенциал этого лечения был подтвержден на крысиной модели трансплантации печени DCD, где комбинация BM-MSC и NMP увеличивала выживаемость после трансплантации на 10% по сравнению с одним только NMP и уменьшала повреждение желчных путей, что подтверждается более высоким уровнем CK19. экспрессия и улучшение желчных протоков [ 80 ]. Та же группа продемонстрировала, что при трансфекции геном гемоксигеназы-1 (HO-1) BM-MSC значительно усиливают свои защитные эффекты. HO-1 — это фермент, участвующий в метаболизме гема, который может снизить перегрузку железом и выработку АФК, что приводит к улучшению жизнеспособности клеток [ 85 ]. В результате, по сравнению с BM-MSC, HO-1-модифицированные BM-MSC (HO-1/BM-MSC), вводимые во время NMP, были более эффективными в снижении повреждения тканей и смертности животных [ 81 , 82 , 83 , 84 ]. На молекулярном уровне HO-1/BM-MSC подавляют HMGB1 и его нижестоящий путь TLR4/NF-κB, что приводит к значительному снижению уровней провоспалительных цитокинов [ 81 ]. Более того, фокусируясь на желчевыводящей системе, HO-1/BM-MSC активируют клетки перибилиарных желез по пути Wnt, эффективно восстанавливая желчные протоки после трансплантации печени DCD [ 84] .]. В мышиной модели острого отторжения лечение HO-1/BM-MSC было связано с увеличением жизнеспособности печени и выживаемости животных, будучи столь же эффективным, как и ингибиторы кальциневрина, в снижении признаков клеточного отторжения. Среди возможных механизмов защиты авторы отметили, что обработанная печень имела меньшую экспрессию INF-γ и инфильтрацию NK- и CD8+ Т-клеток [ 82 ], а также снижение дендритных клеток и активацию CD4+ Т-клеток [ 83 ]. Эти данные представляют исключительный интерес, поскольку подтверждают иммуномодулирующую активность МСК и, наряду с преимуществами их введения ex vivo, делают их потенциальными кандидатами в пользу прогрессивной отмены иммуносупрессии и развития операционной толерантности после ТП [ 86 ].
Верстеген и др. успешно перевел эту технику на модель крупного животного [ 87 ]. Они доставили человеческие МСК в печень свиньи с помощью HMP, продемонстрировав широкий спектр и распределение МСК по всему органу после 30 минут перфузии. В течение 4 последующих часов NMP анализ перфузата подтвердил способность МСК модулировать ключевые воспалительные гены паракринным способом. Знаменательное исследование Laing et al. в конечном итоге доказал осуществимость этого подхода на людях [ 88 ]. В этом исследовании мультипотентные взрослые клетки-предшественники (MAPC) вводили непосредственно в правую долю печени либо через печеночную артерию, либо через воротную вену во время NMP шести выброшенных человеческих печени. Конфокальная микроскопия продемонстрировала приживление MAPC, при этом клетки, наполненные артериями, способны трансмигрировать через эндотелий сосудов. Мультиплексный анализ и протеомный анализ перфузата NMP выявили иммуномодулирующий эффект, связанный с инфузией MAPC.
Таблица 3 Схематический обзор доклинических исследований по изучению терапии на основе МСК, применяемой во время динамической консервации печени.
Клеточная терапия