Модели для исследований на человеке
2D-культур клеток in vitro
_13_ Сегодня исследования лекарств основаны на использовании традиционных 2D-культур клеток in vitro и экспериментах на животных, которые не позволяют должным образом предсказать клиническую эффективность, токсичность и побочные эффекты терапии у людей , поскольку они неадекватны для воспроизведения физиологии человека
Органы на чипах
(позитивный результат не означает быстрое введение в клиническую практику, в отличие от результатов на целых органах. Восстановленные органы востребованы в трансплантологии)
_13_ Технологии «Органы на чипах» (ООС) это миниатюрная микрофизиологическая система для биомедицинских исследований призванная обеспечить ресурсоэффективный ответ на главные вопросы биомедицинского поиска : 1) лучшее понимание механизмов заболеваний и связанных с ними патологических процессов; 2) разработка эффективных терапевтических стратегий лечения заболеваний с ограниченными побочными эффектами и влиянием на условия жизни.

Рис. 3 . Преимущества одной и нескольких ООС-платформ по сравнению с другими методологиями.
Прежде чем приступить к рассмотрению случаев, касающихся различных органов и заболеваний, стоит отметить, что общую классификацию ООС-архитектуры можно провести с точки зрения размерности ЕСМ, различая 2D, 2,5D и 3D модели ( Bennet et al., 2021 ). В 2D-моделях синтетическая мембрана разделяет два вертикально расположенных отсека, а ЕСМ обеспечивает покрытие, способствует адгезии/росту клеток и участвует в определении барьерных и транспортных свойств по отношению к питательным веществам и лекарствам. 2.5D-модели реализуются либо с использованием нескольких мембран с покрытием ECM, либо с заменой мембраны тонкой гидрогелевой пленкой. Вместо этого в 3D-моделях используются толстые слои 3D-гидрогеля, чтобы можно было включить стромальные клетки для лучшего повторения интерстициального матрикса ( Bennet et al., 2021 ).
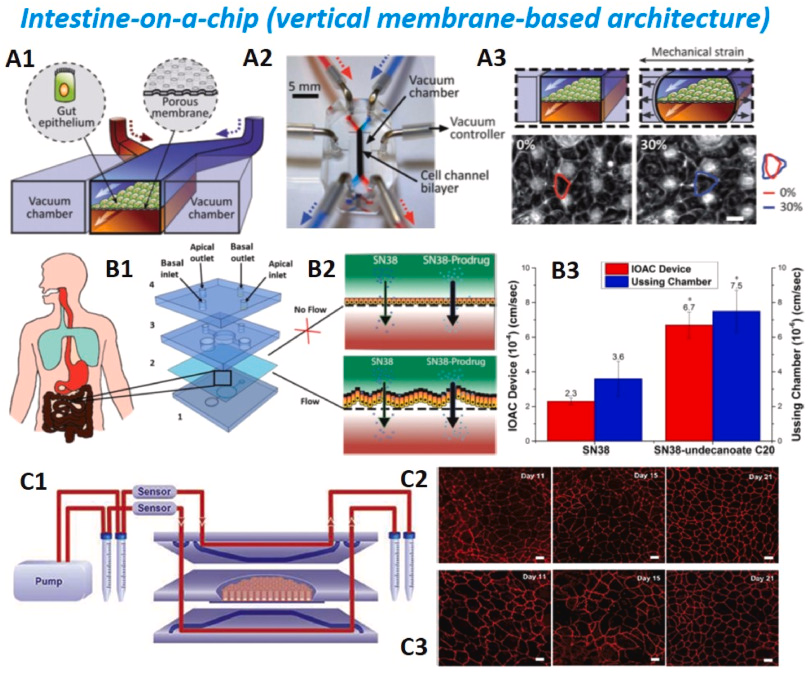
Схематическое изображение устройства «кишка на чипе», в котором мембрана ЕСМ покрыта эпителиальными клетками кишечника и пересекает центральный микроканал между двумя вакуумными камерами. (A2)Фотография устройства «кишка на чипе». Синий и красный красители поступают по трубкам в верхние и нижние микроканалы соответственно, чтобы визуализировать эти каналы. (A3)Схематическое (вверху) и фазово-контрастное изображения (внизу) кишечных монослоев, культивированных в кишечнике на чипе в отсутствие (слева) или присутствии (справа) механического напряжения. Воспроизведено из ссылки. ( Ким и др., 2012 ) . (B1)Структура кишечника на чипе, описанная Pocock et al. с апикальной и базальной камерами, разделенными ПК-мембраной. ( B2)Схема проведенного анализа проницаемости химиотерапевтического агента SN38 через монослои клеток Caco-2. (B3) Сравнение результатов, полученных на платформе ООС и на слизистой оболочке кишечника крысы , установленной в камере Уссинга . Воспроизведено из ссылки. ( Покок и др., 2017 ) . (C1)Микрофлюидный кишечник на чипе, реализованный Kulthong et al. и состоит из трех повторно закрывающихся предметных стекол, в результате чего образуются две микрофлюидные камеры, разделенные полиэфирной (ПЭТ) мембраной, в которой культивируются клетки Caco-2. Поток нагнетался с помощью многоканального воздушного насоса. Снимки конфокального микроскопа : вид сверху слоя клеток Caco-2, демонстрирующий структуру плотных соединений (ZO-1/TJP1) красного цвета, культивированных в течение 21 дня в статической системе Transwell (C2)или системе «кишка на чипе» (C3) )при непрерывном потоке 100 мкл/ч . Воспроизведено из ссылки. ( Култонг и др., 2020 ) .
Рис. 5 . (A1-A2) Модель альвеолярного интерфейса воздух-жидкость, в которой для имитации дыхания используется циклическое давление. (A3) Оценка границы раздела с помощью измерений TEER и флуоресцентного окрашивания. Воспроизведено из ссылки. Ха и др. (2010а) . (B1) Рабочий процесс модели интерфейса воздух-жидкость с посевом эндотелиальных клеток (LMEC), а затем альвеолярных эпителиальных клеток (AEC) в трансвелловой системе. (B2) Эпителий дыхательных путей человека, выращенный на чипе (шкала, 20 мкм) и реснички (синие) на апикальной поверхности эпителия дыхательных путей (шкала, 10 мкм). (B3) Влияние на выработку цитокинов IL-8 на небольших чипсах дыхательных путей, выстланных нормальными или хроническими эпителиальными клетками обструктивной болезни легких (слева), а также на терапевтическую модуляцию цитокинового воспаления (справа). Воспроизведено из ссылки. ( Бенам и др., 2016 ). (C) Схема структур легкого на чипе с альтернативной/планарной архитектурой. Воспроизведено из ссылки. ( Баркал и др., 2017 ; Парк и др., 2018 ; Чжан и др., 2018a ).
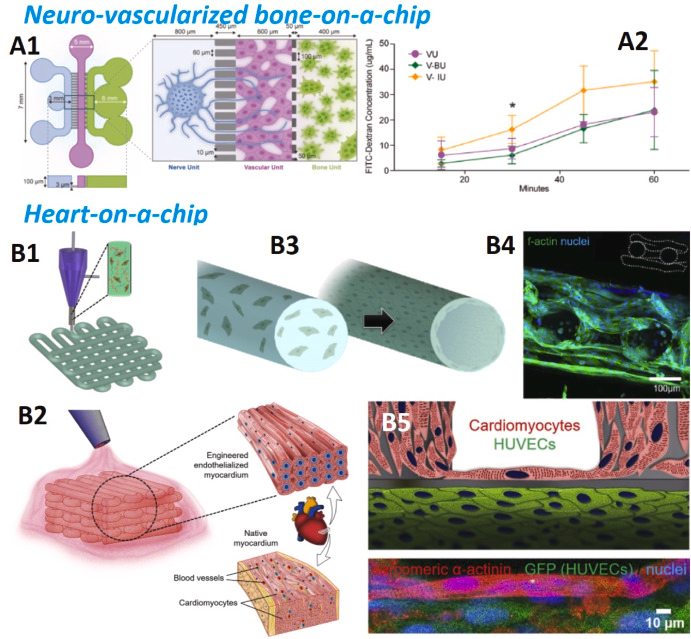
Рис. 10 . (A1) Модель нейроваскуляризированного костного чипа. Воспроизведено из ссылки. ( Нето и др., 2102 ) . (A2)Проницаемость эндотелиального барьера оценивается в сосудистой единице, прилегающей к костной воспалительной единице (V-IU) — остеокластах под воздействием IL-1β — и по сравнению с сосудистой единицей, прилегающей к физиологической костной единице (V-BU) — остеокластах в стандартных условиях культивирования. (B1–B2)Принципиальные схемы процесса изготовления эндотелиализованного миокарда методом 3D-биопечати. (B3) Схема сборки эндотелиальных клеток пупочной вены человека, инкапсулированных в биопечатные микроволокна в слой эндотелия. (B4)Конфокальная флуоресцентная микрофотография, показывающая образование эндотелия эндотелиальными клетками пупочной вены человека. (B5)Схематические и конфокальные флуоресцентные изображения эндотелиализованной ткани миокарда, полученные путем посева кардиомиоцитов неонатальных крыс на биопринтованный эндотелизированный микрофиброзный каркас. Воспроизведено из ссылки. ( Чжан и др., 2016 ) .
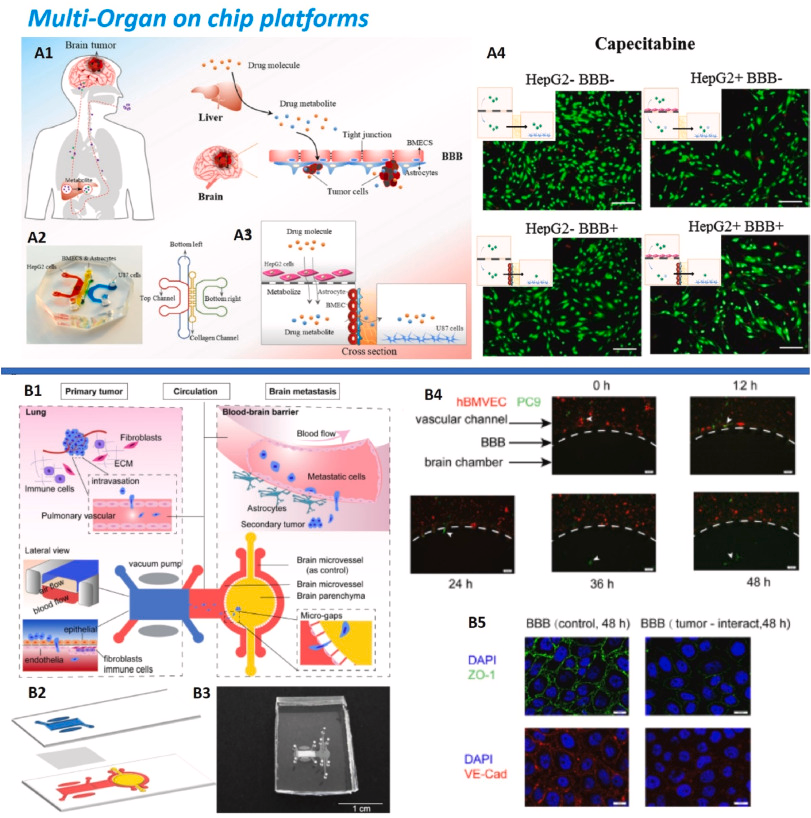
Рис. 13 . (A) Платформа «мультиорган-на-чипе» (печень и мозг): (A1) Путь перорального введения лекарств в опухоли головного мозга посредством метаболической активности печени и через ГЭБ. (A2) MOC, собранный Li et al. чтобы воспроизвести этот процесс, используя клетки HepG2 в верхнем (печеночном) канале, микрососудистые эндотелиальные клетки головного мозга (BMECS) и церебральные астроциты в нижнем левом канале и клетки U87 в нижнем правом канале. (A3) Вид поперечного сечения MOC. (A4) Жизнеспособность клеток U87 в присутствии/отсутствии печеночного отсека и ГЭБ при введении 80 мкМ CAP в течение 2 дней. Живые клетки окрашены в зеленый цвет, мертвые – в красный. Бар: 50 мкм. Воспроизведено из ссылки. ( Ли и др., 2021 ). (B) Устройство MOC для исследования метастазов в мозг при раке легких. (B1) Патологический процесс и его повторение на чипе Liu et al. ( Liu et al., 2019a ) через верхний отдел легких и нижний отдел мозга. (B2) Структура МОК, состоящая из двух слоев ПДМС и мембраны, и (B3) ее реализация, масштабная линейка 1 см. (B4) Экстравазация клеток рака легких PC9 (зеленый) через ГЭБ (красный) на покадровых изображениях; масштабная линейка, 50 мкм. (B5) Конфокальная визуализация экспрессии зонального окклюдина-1 плотного соединения (ZO-1, зеленый) и белков эндотелия сосудов -кадгерина (VE-Cad, красный) в контрольном ГЭБ (слева) и в ГЭБ после опухолевых клеток. экстравазация (справа), свидетельствующая об уменьшении герметичности при взаимодействии сосудов с опухолевыми клетками; Масштабная линейка, 20 мкм. Воспроизведено из ссылки. ( Лю и др., 2019а ).
Более того, современные системы «орган-на-чипе» открывают огромные перспективы для выяснения механизмов, ответственных за неизлечимые в настоящее время заболевания. В этом направлении уже достигнуто несколько важных результатов. Ожидается, что будущие задачи будут связаны с поиском компромиссов между стандартизацией, воспроизводимостью и надежностью при воспроизведении микросреды заболевания и реакцией на лекарства ( Brancato et al., 2020 ), а также переходом к платформам тестирования на основе данных пациентов для персонализированной точной медицины.
Омоложение (восстановление, лечение)
Фармакология
Лекарственная терапия Ultima-ratio
_1 Поскольку EVMP обеспечивает изолированную перфузию эксплантированных органов ex vivo , он обеспечивает новый интерфейс для их лечения с помощью высоких доз лекарств без существенных недостатков, связанных с дозолимитирующими системными побочными эффектами, что приводит к более эффективному терапевтическому успеху. В этом контексте EVMP был создан в качестве терапевтической платформы для проведения ультимативной терапии пораженных органов у пациентов с плохим прогнозом и непереносимыми противопоказаниями для системного введения.
Биоинженерия