Введение. Машинная перфузия ex vivo (EVMP) — это метод сохранения органов, который применяется при трансплантации органов, позволяет длительно сохранять и контролировать органы в режиме реального времени. Постоянное совершенствование протоколов EVMP, особенно увеличение продолжительности хранения, проложило путь к его более широкому применению, в частности, для восстановления и модификации больных органов, а также для лечения опухолей и инфекций и регенеративных подходов. Более того, внедрение EVMP для доклинических исследований in vivo , улучшающих моделирование заболеваний, вызывает значительный интерес, обеспечивая при этом идеальный интерфейс для биоинженерии и генетических манипуляций. Эти подходы могут применяться не только при аллогенной и ксеногенной трансплантации, но и при аутологичной трансплантации, когда пациенты могут находиться на временной органной поддержке, в то время как больные органы лечатся ex vivo с последующей реимплантацией вылеченного органа.
ОБЩАЯ СХЕМА ОБОРУДОВАНИЯ ДЛЯ ПЕРФУЗИИ
Хотя был разработан широкий спектр протоколов консервации, включающих EVMP для различных органов, все системы перфузии ex vivo состоят из перекрывающихся общих компонентов.
Камера органов содержит соответствующие органы, соединенные сосудистыми портами с перфузионной системой. Орган перфузируется с помощью встроенного центробежного или роликового насоса, который обеспечивает непрерывный или пульсирующий поток крови через канюлю артериального притока, в то время как кровь дренируется через тракт венозного оттока. Резервуар, расположенный ниже по потоку, собирает циркулирующий перфузионный раствор, что также облегчает оптический контроль достаточного уровня жидкости во избежание аспирации воздуха. Посредством системы нагревателя/охладителя перфузионный раствор постоянно поддерживается в гипо-, субнормо- или, скорее, нормотермическом состоянии, в зависимости от основного протокола перфузии. Обогащенный добавками перфузат гарантирует снабжение питательными веществами, в то время как оксигенатор обеспечивает необходимую оксигенацию и декарбоксилирование перфузата, что является предпосылкой для достаточного клеточного метаболизма. Хотя все системы перфузии ex vivo работают как закрытые системы, в различных местах предусмотрены порты для подачи добавок и замены перфузата или отбора проб. Наконец, блок мониторинга контролирует не только общие (например, веноартериальное давление), но и органоспецифические характеристики (например, частоту сердечных сокращений).
ДОПОЛНИТЕЛЬНОЕ ОБОРУДОВАНИЕ
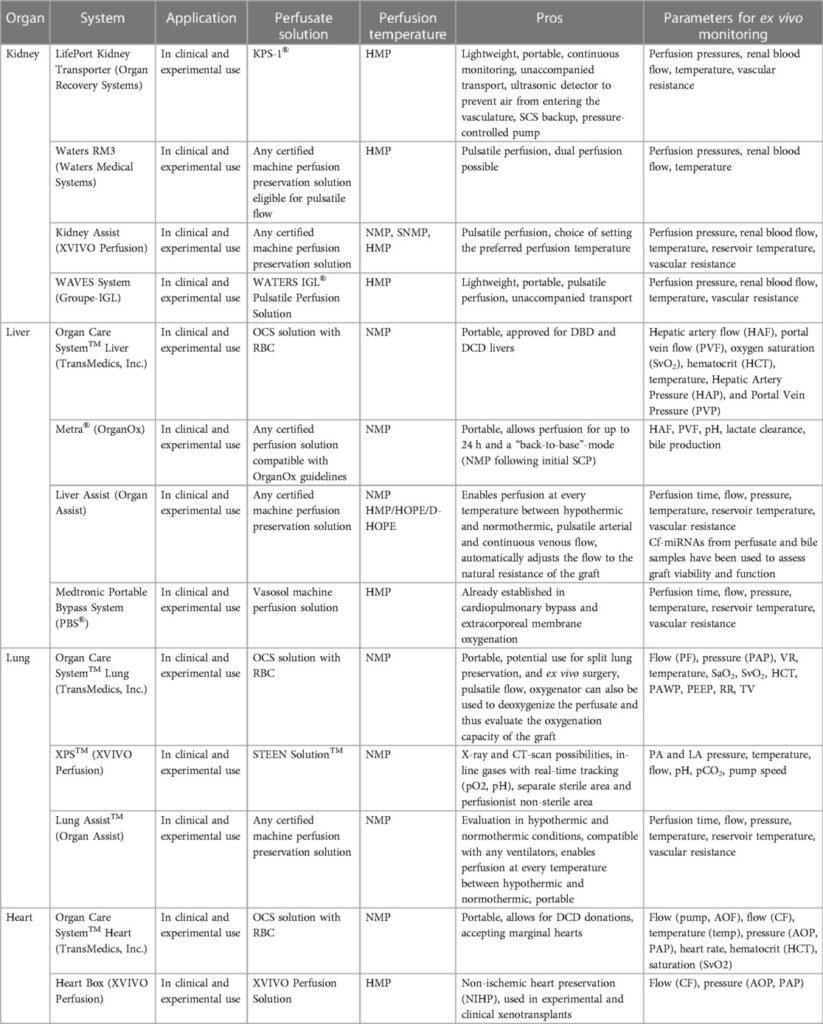
Для создания «почти физиологической» среды для соответствующего перфузируемого ex vivo органа в основной кровоток включаются отдельные дополнительные компоненты, которые реализуются в различных органоспецифичных перфузионных системах ex vivo (см. таблицу, — Созданы системы EVMP для экспериментального и клинического использования для каждого органа._1).
Лейкоцитарный фильтр. Для удаление накапливающихся токсичных метаболитов во время перфузии ex vivo. Его эффективность остается неясной, поскольку не наблюдалось никаких различий в провоспалительных цитокинах и лейкоцитах или параметрах клинических исходов, вероятно, из-за быстрого насыщения фильтра донорскими лейкоцитами, как было исследовано при ЭВМП легких свиней ( 11 _1).
В ЗАВИСИМОСТИ ОТ ОРГАНА — СИСТЕМЫ
Системы почек
Было разработано несколько систем EVMP для почек, которые в настоящее время используются в клинической практике. К ним относятся LifePort Kidney Transporter (системы восстановления органов, 1–5°C), Waters RM3 (Waters Medical Systems, от 3°C до 8°C), Kidney Assist (XVIVO Perfusion) и система WAVES (IGL Group). Хотя несколько перфузионных растворов находятся в стадии исследования, единственной жидкостью с клинически доказанной эффективностью для машинной перфузии почек (HMP/ГМП) является Kidney Perfusion Solution-1 (KPS-1®).
На сегодняшний день LifePort Kidney Transporter является наиболее часто используемым перфузионным устройством для клинической почечной ГМП. Kidney Assist (XVIVO Perfusion), обеспечивает пульсирующую перфузию в гибком диапазоне температур (12–37°C), таким образом, представляя собой единственное устройство, способное осуществлять нормотермическую перфузию почек. Она одобрена FDA и может использоваться с любым сертифицированным решением для консервации оборудования, но не является портативным. Клиническая осуществимость и безопасность были продемонстрированы при сопоставимых результатах как для оксигенированной, так и для неоксигенированной перфузии ( 15_1 ).
Системы печени
В настоящее время для клинического использования доступны три различных устройства EVMP для консервации печени, а именно: Liver Assist (Organ Assist), Organ Care System™ Liver (TransMedics, Inc.? при 34°C) и портативная байпасная система Medtronic (PBS®, 4–6°C).
Liver Assist (XVIVO Perfusions) — наиболее часто используемое устройство EVMP для перфузии печени, совместимое с любым сертифицированным решением для машинной консервации. Обеспечивая пульсирующий поток при температуре от 12°C до 37°C, он представляет собой единственное доступное в настоящее время устройство, способное осуществлять HMP печени или гипотермическую оксигенированную машинную перфузию (HOPE). Однако он непереносим, поэтому требует комбинаторного подхода с другими стратегиями сохранения.
Легочные системы
Для ЭВМП легких конкретные компоненты включают респиратор для вентиляции легких во время аппаратной перфузии, позволяющий также использовать различные режимы вентиляции, и дополнительный порт, позволяющий проводить бронхоскопию. Это основано на экспериментальных данных, которые показали положительный эффект непрерывной искусственной вентиляции легких во время аппаратной перфузии.
В настоящее время доступны три системы для клинического ЭВМП легких, включая Organ Care System™ Lung (TransMedics, Inc., 34–37 °C), XPS™ (XVIVO Perfusion, 35–37 °C) и Lung Assist™ (Organ Assist, 12–37 °C).
Системы сердца
В дополнение к другим органам, ЭВМП сердца также требует модификаций аппаратной перфузионной системы, включая кабели для дефибрилляции или кардиостимуляции. В настоящее время в клинической практике используются две аппаратные системы перфузии сердца, включая Organ Care System™ Heart (TransMedics, Inc.) и Heart Box (XVIVO Perfusion).
Система Organ Care System™ Heart перфузирует при 34–37 °C и обеспечивает пульсирующий поток к трансплантату, содержащий в перфуазате эритроциты и донорскую кровь. В 2021 году одобрение FDA было получено на органы от доноров DBD, а совсем недавно и на органы DCD, что сделало его единственным устройством, одобренным FDA на данный момент.
Heart Box (XVIVO Perfusion), напротив, использует HMP при температуре 8°C и перфузирует сердце насыщенным кислородом раствором кардиоплегических питательных гормонов и ABO-совместимыми эритроцитами. Heart Box совсем использовался при первой ксеногенной ксенотрансплантации от свиньи к человеку ( 39_1 ).
ПЕРФУЗИОННЫЕ РАСТВОРЫ (СДЕЛАТЬ ТАБЛИЦУ ПО РАСТВОРАМ?)
В (суб)нормотермических условиях перфузионные растворы позволяют сохранять органы в псевдофизиологической среде с адекватным кислородом, питательными веществами и метаболическим обеспечением. Перфузаты необходимы для баланса клеточной гидратации и электролитного гомеостаза для предотвращения отеков, а также для уменьшения количества поглотителей пероксидов свободных радикалов и минимизации оксидатного повреждения ( 40 _1). Однако на сегодняшний день оптимальные характеристики перфузии и составы перфузата для режимов EVMP остаются неопределенными и, следовательно, не стандартизированы. Эта неопределенность в основном связана с изменчивостью применения системы EVMP, продолжительностью, температурой и условиями потока. Соответственно, доступен широкий спектр растворов с различным клеточным составом и добавками.
Базовые перфузионные растворы
Перфузаты подразделяются на внеклеточные (т. е. составы с высоким содержанием натрия и низким содержанием калия) и внутриклеточные (формулы с низким содержанием натрия и высоким содержанием калия) растворы. Оба варианта были успешно протестированы в исследованиях EVMP, причем их превосходство, по-видимому, зависит от конкретного случая и состояния органа ( 41 _1). Кроме того, состав базовых перфузионных растворов может колебаться в зависимости от установленной температуры. Поэтому важно обеспечить правильный уровень температуры в течение всего процесса перфузии ( 42_1 ). Хотя безопасность и возможность использования внеклеточноподобного лактата Рингера были продемонстрированы в клинических испытаниях EVMP на людях ( 43_1 ), раствор внутриклеточного типа Университета Висконсина (UW) также имеет смысл существования в сохранении органов. При клиническом использовании этих растворов температуру перфузии поддерживали на уровне 34°C и 21°C соответственно ( 8 , 44_1 ). Совсем недавно в качестве альтернативы UW появился раствор Института Жоржа Лопеса (IGL-1), отличающийся более низкой вязкостью и уровнем калия и заменяющий гидроксиэтилкрахмал (ГЭК) полиэтиленгликолем (ПЭГ) в качестве онкотического агента. Этот раствор использовали при температуре 4–6°C ( 45 _1) (NCT01317342).
Раствор XVIVO Göteborg STEEN представляет собой буферный внеклеточный раствор с хорошо задокументированной эффективностью в области ЭВМП легких и печени и используется при температуре 37°C ( 46_1 ). Он включает человеческий сывороточный альбумин и декстран, которые обеспечивают сильное осмотическое давление и покрывают эндотелий от взаимодействия лейкоцитов. Таким образом, было обнаружено, что перфузия и схема STEEN поддерживают стабильность и функциональность органов — даже во время длительной ЭВМП ( 46_1 ). Примечательно, что этот раствор может быть дополнен эритроцитами или оставаться бесклеточным ( 41_1 ). Кроме того, арсенал перфузатов включает в себя широкий спектр модификаций, таких как раствор гистидина-триптофана-кетоглутарата (НТК) Custodiol-MP с высоким потоком, низким содержанием калия и антинитрозирующими / окислительными свойствами, разработанный для оксигенированного EVMP при 4 ° С. C ( 47_1 ), раствор Cell Organ Care System с формулой декстрана с низким содержанием калия (при 37°C) ( 48 _1), Perfadex в качестве раствора для консервации внеклеточного электролита и электролита на основе декстрана (при 37°C–38°C) ( 49 _1) или раствор Цельсиора в виде безколлоидного раствора внеклеточного типа (при 2–8°C) ( 50 _1). Помимо вышеупомянутых решений по консервации, были описаны и другие ( 8 , 51 , 52 _1).
Клеточный и газовый состав
В то время как гипотермическая МП может проводиться с активной оксигенацией или без нее, при нормотермической МП адекватная оксигенация остается жизненно важной и может доставляться либо эритроцитами, синтетическими переносчиками кислорода, либо диффузионным кислородом с помощью газовых смесей карбогена ( 53 _1). Поскольку перфузаты на основе цельной крови могут оказывать патогенные эффекты, обусловленные гемолизом и остаточными компонентами крови, включая клетки, комплемент и воспалительные факторы ( 54 )_1, а также связаны с логистическими препятствиями и ограниченными поставками ( 55_1 ), истощение лейкоцитов/тромбоцитов и плазма Свободные перфузаты приобрели популярность в доклинических и клинических исследованиях ( 12 , 56–58_1 ) .
В большинстве исследований использовались перфузионные растворы на основе эритроцитов. Известно, что такие перфузаты эффективно транспортируют кислород, а их постоянный поток может смягчить напряжение сдвига ( 59_1 ). Однако растворы на основе крови по своей сути несут в себе риск передачи инфекции и инцидентов, связанных с переливанием крови, включая гемолиз. Поэтому было предложено множество альтернатив, начиная от искусственных носителей кислорода, таких как полимеризованные носители кислорода на основе бычьего гемоглобина и пиридоксилированный бычий гемоглобин, до бесклеточных переносчиков кислорода, таких как STEEN ( 60 , 61 _1). Эти современные решения также предлагают преимущество удобного хранения и транспортировки — при одинаковой эффективности и реолого-гемодинамических характеристиках ( 62 , 63 _1).
Уникально то, что бесклеточные перфузаты позволяют постепенно согревать трансплантат от гипотермии до нормотермических условий. Это преимущество является значительным, поскольку увеличение скорости метаболизма, связанное с резким восстановлением нормотермии, считается вторичной причиной ИРИ ( 64 , 65 _1). Хотя смеси с супрафизиологическими концентрациями кислорода обычно используются в протоколах EVMP, гипероксемия и различное напряжение кислорода требуют дальнейших исследований, особенно в сочетании с бесклеточными перфузатами ( 41 _1). Интересно, что сероводород был идентифицирован как потенциальная добавка, вызывающая гипометаболическое состояние и снижающая потребление кислорода, тем самым открывая путь к использованию нормоксических смесей ( 66 ). Дополнительные газообразные добавки могут включать окись углерода, которая, как было обнаружено, способствует расширению сосудов и снижению IRI ( 67 , 68 _1), или аргон, который в настоящее время исследуется ( 69 _1).
Дополнительные субстраты
Попурри из дополнительных и модифицируемых компонентов можно смешивать с перфузионными растворами, чтобы имитировать нормальный обмен веществ и воссоздать среду, близкую к физиологической. Исследованные добавки включают метаболические субстраты, буферы, онкотические агенты, антикоагулянты, сосудорасширяющие средства, антиоксиданты, противовоспалительные молекулы и гормоны. Например, субстраты для энергетического обмена и питательные вещества необходимы для поддержания клеточного метаболизма во время перфузии, тем самым повышая жизнеспособность клеток. Такие добавки, как глюкоза 5% или инсулин, популярны для всех типов ЭВМП. Кроме того, пируват был исследован в качестве метаболического субстрата при сердечном ЭВМП, и было обнаружено, что он усиливает метаболизм миокарда ( 70 _1). Более того, буферные агенты необходимы для поддержания уровня pH, близкого к физиологическому, поскольку изменения, как наблюдалось, отрицательно влияют на другие физиологические параметры, такие как pCO2 и HCO3 — ( 71 _1). Например, бикарбонат натрия и глюконат кальция могут служить универсальными буферами pH и кальция. Онкотические агенты включаются в различные растворы для консервации органов с целью ограничения отека тканей и последующей гибели клеток. Были использованы такие молекулы, как ГЭК и ПЭГ, которые могут иметь дополнительные полезные эффекты, такие как защита митохондрий и гликокаликса ( 72 _1). Кроме того, 10% маннит является хорошо зарекомендовавшим себя ингредиентом, применимым в различных органах и повышающим осмоляльность ( 41 _1).
Перфузаты на основе крови легко дополняются антикоагулянтами для предотвращения свертывания крови в просвете трубки и снижения риска тромбоза. Для этой цели перфузат обычно гепаринизируют или фильтруют через сетку ( 8 , 41 , 73 , 74 _1). Более того, уровни оксида азота (NO) снижаются во время реперфузии, вызывая вазоконстрикцию и, в конечном итоге, приводя к длительной клеточной ишемии и усугубляемому некрозу ( 75 _1). По этой причине для компенсации временного сужения сосудов при реперфузии можно применять вазодилататоры, такие как верапамил или простациклин ( 76 _1). Следует отметить, что ценность такого лечения (т.е. гладкой (микро)циркуляции крови и перфузии органов) в бесклеточных перфузатах еще предстоит определить ( 41 , 77 _1). Интересно, что в бесклеточных растворах биополисахарид декстран оказался важным ингредиентом, предотвращающим патологическое взаимодействие лейкоцитов и эндотелия посредством антитромботических свойств и защищающим целостность богатых эндотелием органов. Таким образом, добавление декстрана в перфузат может способствовать здоровью сосудистой сети и стабильной функции органов ( 55 _1). Антиоксиданты и противовоспалительные молекулы также подвергались обширным исследованиям в качестве добавок, поскольку они удаляют активные формы кислорода (АФК), возникающие в результате ИРИ, и ослабляют иммунологический ответ ( 78 _1). Таким образом, различные агенты, включая витамин С, кверцетин и ресвератрол, показали положительный эффект ( 79 , 80 _1). Кроме того, стоит отметить, что витамин С также улучшает микроциркуляцию и уменьшает воспаление во время ЭВМП. Однако клинические преимущества остаются спорными ( 81 _1). Гормоны представляют собой еще одну группу потенциальных добавок с широким спектром функциональных свойств ( 82 _1). Например, в экспериментальном NMP печени было обнаружено, что мелатонин предотвращает окислительный стресс и улучшает сосудистую проводимость ( 83 _1). Более того, дофамин уменьшал гистологические признаки повреждения и улучшал выработку желчи ( 84 _1). Другие исследуемые гормоны включают эритропоэтин и глюкагон ( 82 , 85 , 86 _1). Кроме того, EVMP обеспечивает потенциальную возможность введения терапевтических препаратов, включая химиотерапевтические препараты или антибиотики, противовирусные и антимикотические средства, для снижения микробной, бактериальной, вирусной и грибковой нагрузки на инфицированные органы и/или в целях профилактического лечения ( 87 _1). . Стоит отметить, что опубликованные протоколы демонстрируют большие различия в отношении используемых добавок. Таким образом, добавки, перечисленные здесь, представляют собой лишь выборку.
Температура перфузии
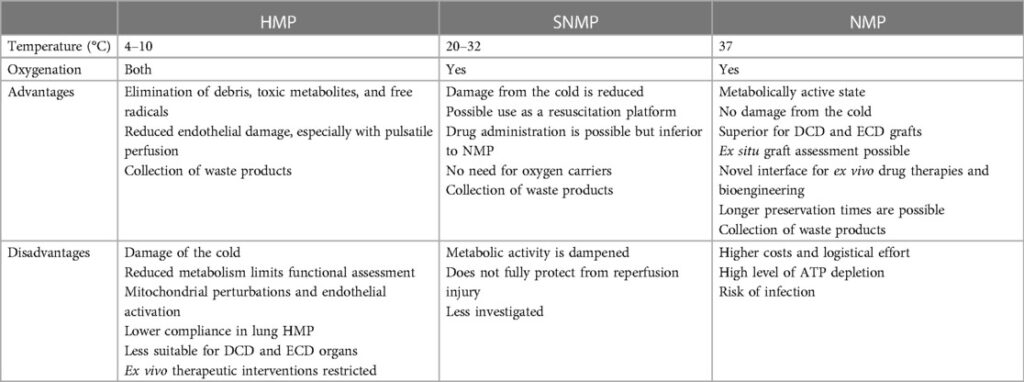
Методы EVMP можно классифицировать в зависимости от температуры, применяемой во время консервации, условно различая их на холодные, субнормотермические и NMP, которые нашли различное применение в клиниках в зависимости от интересующего органа ( таблица 2_1 ).
Гипотермическая консервация
Гипотермическая консервация при температуре от 4°C до 10°C позволяет удалить мусор, токсичные метаболиты и свободные радикалы, образующиеся во время гипотермии, которые в противном случае накапливались бы при холодном статическом хранении ( 88 _1).
Однако из-за гипотермического состояния метаболическая активность органа резко снижается во время функциональной оценки органа, ограничивающей перфузию ( 91 _1). Что еще более важно, консервированные при гипотермии трансплантаты все еще подвергаются холодовому ишемическому повреждению из-за инактивации насосов Na + /K + ( 92 , 93 _1).
Уменьшение метаболической активности снижает фармакодинамику в ответ на терапию?
Всё это приводит к снижению возможности восстанавливать орган?
убнормотермическая перфузия
Субнормотермическая машинная перфузия (СНМП) предполагает сохранение эксплантированных органов при температуре 20–32 °С и в настоящее время проходит экспериментальную оценку. По сравнению с НМП, холодовое повреждение трансплантата значительно снижается, в то время как усиление метаболической активности, происходящее при НМП, в то же время ослабляется. Таким образом, метаболическое состояние, требующее дополнительных переносчиков кислорода для адекватной оксигенации, не достигается ( 102_1 ). Однако клинические данные о трансляционной значимости этой процедуры скудны, а Kidney Assist является единственным коммерчески доступным устройством для SNMP.
НМП (НОРМОТЕРМИЧЕСКАЯ МАШИННАЯ ПЕРФУЗИЯ)
NMP позволяет тканям органов оставаться метаболически активными и предотвращает воздействие холода, тем самым сводя к минимуму CIT. Сохранение трансплантата, таким образом, обеспечивает нормальный клеточный метаболизм и восстановление производства АТФ в почти физиологических условиях ( 58 _1), тогда как метаболиты трансплантата могут быть вымыты, оптимизировано снабжение питательными веществами и сохранено микрососудистое кровообращение. Таким образом, NMP считается методом выбора для маргинальных донорских органов с успешными клиническими исследованиями печени, легких и сердца ( 105–107_1 ) , включая органы DCD и ECD . Более того, NMP маргинальных почек показал положительный эффект на экспериментальных моделях на свиньях ( 108 _1).
Кроме того, NMP является единственной формой машинной перфузии, которая позволяет провести предтрансплантационную оценку органа ex vivo , что может как облегчить принятие решений по использованию трансплантата, так и позволить оценить трансплантат во время терапии ex vivo ( 109 _1). Таким образом, при ЭВМП печени оценивался широкий спектр критериев жизнеспособности, таких как клиренс лактата, продукция желчи, рН перфузата, метаболизм глюкозы, скорость кровотока и перфузатные трансаминазы ( 22 , 110 , 111 _1). Однако ни один из этих параметров не был установлен в качестве клинических рекомендаций, поскольку большинство исследований неизменно основаны на небольших сериях с небольшим количеством случаев, несмотря на то, что они были рандомизированными или слепыми. Необходимы более крупные совместные исследования, направленные на подтверждение потенциальных биомаркеров или общих баз данных, позволяющих сопоставлять полученные данные, которые могут поддержать клинический перевод.
Дальнейший интерес представляет то, что предыдущие исследования EVMP сердца продемонстрировали возможность использования микрозондов твердофазной микроэкстракции (SPME) с последующим метаболомным профилированием для выявления динамических метаболических изменений, связанных с повреждением и восстановлением органов ( 112 _1), что может расширить диапазон параметров, контролируемых во время EVMP в будущих исследованиях.
Помимо функциональной оценки, NMP представляет собой новый интерфейс для терапии ex situ , поскольку фармакокинетика и фармакодинамика лекарств не должны изменяться под воздействием низких температур во время HMP. Что наиболее важно, NMP позволил значительно продлить время консервации для всех типов органов: 24 часа в почках ( 113 _1), 1 неделю в печени ( 114 _1), 3 дня в легких ( 115 _1), 24 часа в сердце ( 116 _1) EVMP. Длительное время хранения, в свою очередь, дает возможность проводить методы лечения ex vivo , требующие длительного времени применения, включая генную терапию, биоинженерию и хирургию ex vivo .
УСЛОВИЯ ПОТОКА
Форма потока
Условия потока являются важнейшими параметрами EVMP, поскольку они регулируют снабжение трансплантата кислородом и питательными веществами, а также клиренс CO 2 и продуктов метаболизма. Кроме того, было показано, что условия кровотока влияют на органозащитные эффекты перфузионных растворов и опосредуют возникновение отека трансплантата ( 8_1 ).
По форме потока можно выделить пульсирующий и непрерывный поток. Например, было обнаружено, что пульсирующий поток во время искусственного кровообращения значительно улучшает восстановление жизненно важных органов на нескольких типах моделей животных, связанных с сохраненной микроциркуляцией, по сравнению с непрерывным потоком ( 118 , 119 _1). Пульсирующий поток, в свою очередь, генерирует напряжение сдвига сосудов, которое, как считается, влияет на экспрессию и функцию эндотелиальных генов ( 5 , 38 _1). Действительно, пульсирующее давление может улучшить почечный кровоток при перфузии изолированной почки, улучшая сосудистую проводимость, что приводит к увеличению клиренса креатинина, реабсорбции натрия и уменьшению повреждения канальцевых клеток ( 120 _1). Механически лучшая сосудистая проводимость при пульсирующей перфузии в почках может быть связана с улучшением эндотелиального высвобождения NO и снижением секреции эндотелина-1 ( 121 _1). Однако исследования, сравнивающие непрерывную и пульсирующую перфузию парных почек, не выявили существенных различий в выживаемости трансплантата и функции почек ( 7 _1). Кроме того, экспериментальное исследование легких свиней не выявило значительного улучшения параметров функции легких при использовании модифицированного роликового насоса, генерирующего пульсирующий поток ( 122 _1). В совокупности клинически применимых данных недостаточно, и необходимы дополнительные исследования форм потока, особенно с учетом температуры, перфузата и соответствующего перфузируемого органа. Хотя клинические исследования у пациентов с искусственным кровообращением указывают на положительный эффект пульсирующей перфузии ( 118 _1), еще предстоит выяснить, применимо ли это также и к клиническому ЭВМП.
Скорость потока
Скорость потока представляет собой еще один важный параметр органзащитной перфузии, который в основном изучается при ЭВМП легких. Существует несколько протоколов, использующих разные проценты сердечного выброса донора или фиксированные скорости потока, включая протокол Лунда (100% сердечного выброса) ( 123 _1), протокол Торонто (40% сердечного выброса) ( 124 _!) и протокол OCS (2 –2,5 л/мин) для ЭВМП легких ( 5 _1). Поскольку все исследования, изучающие эти протоколы, сравнивают результаты с SCS, прямое сравнение между протоколами невозможно. Более того, различия в дизайне исследования, типе трансплантата легких и характеристиках пациентов не позволяют провести статистически значимое сравнение между этими протоколами ( 125 _1). Примечательно, что экспериментальные исследования также исследовали более низкие скорости потока по сравнению с потоками EVMP 40–20% в легких DCD свиней. Интересно, что улучшение функции легких, уменьшение отека и ослабление воспаления после трансплантации наблюдались при использовании целевого потока в 20% ( 126 _1). Подтверждающие клинические данные получены в исследованиях, сравнивающих машинную перфузию с высоким и бесклеточным потоком с высоким потоком, демонстрирующих более высокую пригодность трансплантата, более высокое изменение соотношения влажного и сухого и меньшее гистологическое повреждение легких в группе с низким потоком ( 127 _1).
Сердце
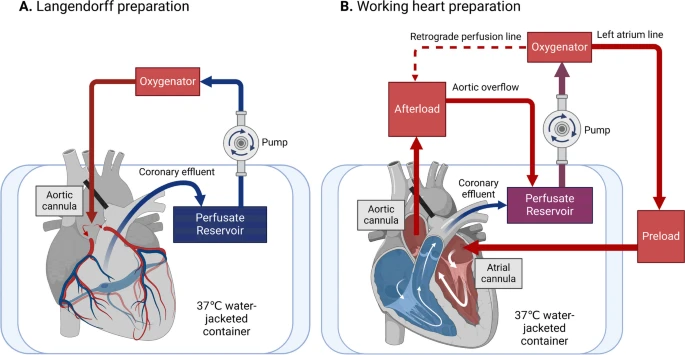
2_ … метод ретроградно-перфузионного сердца по Лангендорфу (известный как «сердце Лангендорфа») стал основой всех современных препаратов изолированного сердца. …. вырезанное сердце канюлируют в аорту, при этом кровь течет по аорте в противоположном направлении от физиологического потока. Аортальный клапан закрывается из-за гидростатического перфузионного давления, и кровь затем течет в коронарные артерии, чтобы перфузировать все сердце. Венозная кровь оттекает через коронарный синус в правое предсердие, затем выбрасывается через легочную артерию и собирается в резервуар.
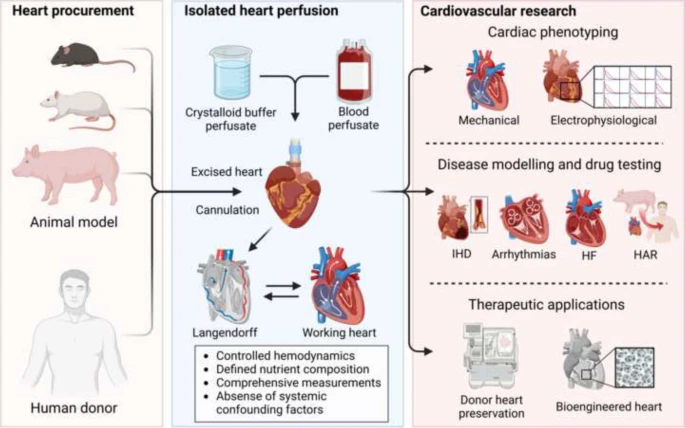
2_изолированный препарат «работающего сердца», имитирующий физиологическую нагрузку сердца [ 7 ]. При введении дополнительной канюли в левое предсердие изолированное сердце переводят в «рабочий режим» для выброса перфузата с контролируемым давлением преднагрузки, сравнимым с сердцем в физиологических условиях (рис. 1 Б). Этот препарат позволяет проводить функциональные и метаболические оценки сердца при различной преднагрузке и постнагрузке.