Модуль имитации сердца и сосудов: (Насосы – Трубка — Давление — Канюляция — Поток )
Таблицу MP_H 1(a-e)
Физиология
Ключевой предпосылкой физиологии млекопитающих является циркуляция крови, реализуемая насосным механизмом сердца. Поэтому крайне важно, чтобы печень ex situ нуждалась в сопоставимой циркуляции для поддержания внутренней среды, включая доставку O2 и необходимых питательных веществ, а также удаление CO2 и токсичных отходов. Сердце обеспечивает пульсирующий поток с высоким давлением через артерии к органам, где сопротивление расширенного капиллярного русла вызывает снижение давления, и непрерывный поток возвращается через вены обратно к сердцу.
Особенности кровоснабжения печени отражают её важную биологическую функцию детоксикации: кровь от кишечника, содержащая токсичные вещества, потреблённые извне, а также продукты жизнедеятельности микроорганизмов (скатол, индол и т. д.) по воротной вене (v. portae) доставляются в печень. Далее воротная вена разделяется до более мелких междольковых вен. Артериальная кровь поступает в печень по собственной печёночной артерии (a. hepatica propria), разветвляясь до междольковых артерий.
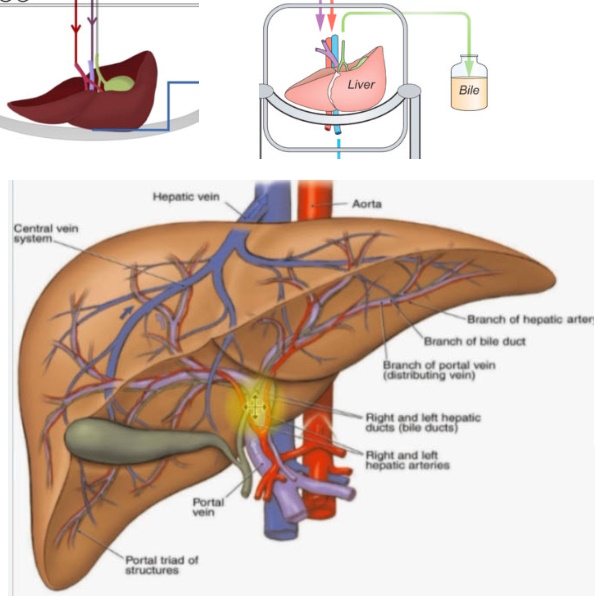
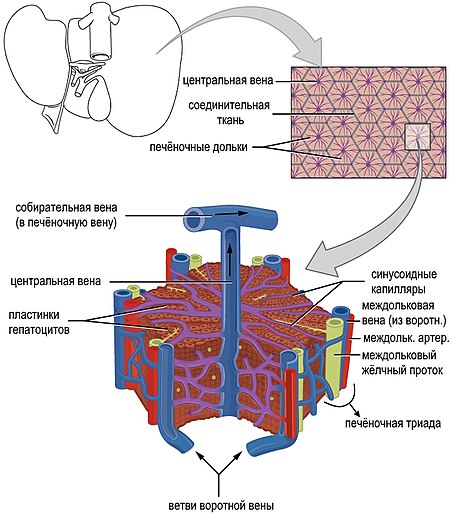
Непосредственно перед тем, как достичь печени, воротная вена разделяется на правую и левую. Она разветвляется дальше, образуя более мелкие венозные ветви и в конечном итоге воротные венулы. Каждая воротная венула проходит вдоль печеночной артериолы, и два сосуда образуют сосудистые компоненты воротной триады . Эти сосуды в конечном итоге впадают в печеночные синусоиды , чтобы снабжать печень кровью. Междольковые артерии и вены выбрасывают кровь в синусоиды, где, таким образом, течёт смешанная кровь, дренаж которой происходит в центральную вену. Центральные вены собираются в печёночные вены и далее в нижнюю полую вену. В эмбриогенезе к печени подходит т. н. аранциев проток, несущий кровь к печени для эффективного пренатального гемопоэза.
Общие замечания
При длительном НМП необходимо минимизировать напряжение сдвига в перфузионном контуре, поддерживая при этом адекватные значения давления и характеристик потока для достижения однородной перфузии. Трубка для долгосрочного сохранения МП печени должна соответствовать нескольким критериям. Она должна быть изготовлена из такого материала, как медицинский гибкий полимер, который прочен и должен быть покрыт синтетическим полимером или гепарином для минимизации отслоения и повышения биосовместимости. Трубка должна иметь правильную длину и диаметр для поддержания ламинарного потока, стабильного давления и минимизации повреждения перфузата.
Насосы 1(a)
Насосы являются необходимым компонентом МП для создания поступательного движения жидкости. Большинство аппаратов для перфузии органов используют роликовые или центробежные насосы, которые могут создавать непрерывный или пульсирующий поток ( 14 , 15 , 19 ). Кроме того, все еще много споров о том, какой тип насоса лучше всего подходит для поддержания перфузионного раствора, включая кровь (компоненты), в оптимальном состоянии. Компоненты крови, такие как эритроциты (эритроциты), могут быть повреждены (гемолиз) при использовании в МП из-за механических сил. Степень гемолиза связана с воздействием сдвигающих сил и продолжительностью воздействия (20). Некоторые исследования показали меньший гемолиз при использовании центробежных насосов по сравнению с роликовыми насосами, тогда как другие не показали никакой разницы или наоборот ( 20 ).
Трубки 1(b)
В организме существуют различные виды кровеносных сосудов: артерии, капилляры и вены. Все они имеют свои собственные характеристики и функции ( 24 ). Артерии имеют тиккер, эластичную стенку, в целом они меньше в диаметре, чем вены, и используются для перемещения крови от сердца к другим органам. Капилляры состоят из одного слоя клеток, что облегчает обмен O2 , питательными веществами и продуктами жизнедеятельности внутри органа или ткани. Вены имеют более тонкую стенку и клапаны, что облегчает поток крови обратно к сердцу и функционируют как резервуар основного количества крови организма. Используемые в настоящее время перфузионные аппараты часто не различают трубки между HA и PV. Иногда отличается только диаметр трубки, при этом для PV используется более широкая трубка ( 12 , 25 ). Капилляры существуют внутри печени и их не нужно моделировать.
Может быть важно учитывать длину и диаметр трубки. Давление перфузии и поток в трубке можно описать уравнением Хагена-Пуазейля:
ΔP=8μ𝐿𝑄/π𝑟4( 1 )
где ΔP — разность давлений (в Па), L — длина трубки (в м), μ — вязкость перфузата (в Па.с), Q — скорость потока (в м 3 /с), а r — радиус трубки (в м). Это уравнение показывает важность длины и, особенно, диаметра трубки для потока и давления в системе. Другим важным уравнением является уравнение Дарси–Вейсбаха для поддержания ламинарного потока
𝑅𝑒= 𝜌𝜐𝑑/μ (2)
где Re — число Рейнольдса, p — плотность жидкости (в кг/м 3 ), v — средняя скорость потока (м 2 /с), d — диаметр (в м), а μ — вязкость жидкости (в Па.с). Когда Re становится слишком высоким (>2400), поток становится турбулентным, что изменяет соотношение потока и давления ( 24 ). Это может быть физиологическим, но также может вызвать повреждение перфузата, например гемолиз ( 20 ). Наиболее оптимальная длина и диаметр трубки для HA и PV в сочетании с различными перфузионными жидкостями еще не установлены.
Существует несколько видов трубок, все со своими уникальными свойствами, но не все подходят для долгосрочного сохранения органов МП. Большинство медицинских трубок изготавливаются из поливинилхлорида, смешанного с пластификаторами для получения гибкости ( 26 ). Обычно использовался пластификатор di(2-ethylhexyl) phthalate, но ди(2-этилгексил)фталат имеет тенденцию мигрировать из пластика при воздействии липидных и протеинсодержащих веществ, таких как кровь и альбумин ( 26 , 27 ). Пациенты или изолированные органы, подвергавшиеся воздействию этих трубок, могут впитывать этот материал, что вызывает беспокойство из-за его потенциального токсического и воспалительного воздействия ( 28 , 29 ). Раскалывание (т. е. отрыв фрагментов полимера) может не только вызывать токсические эффекты, но и вызывать микроэмболии ( 30 ). Это может представлять дополнительную проблему при долгосрочном перфузии органов из-за длительности воздействия. Другие пластификаторы, такие как tris(2-tthylhexyl) trimellitate, заменили ди(2-этилгексил)фталат и, по-видимому, вызывают меньшее расщепление ( 26 , 31 ). Важен не только материал трубки, но и покрытие внутренней части трубки. Трубка может быть покрыта тонким слоем субстрата, чтобы предотвратить повреждение трубки или перфузионной жидкости. Покрытие может минимизировать отслоение, а также уменьшить активацию и потерю гранулоцитов и тромбоцитов, при этом синтетическое полимерное покрытие работает лучше, чем гепариновое покрытие, в снижении воспалительных реакций ( 20 ,32–34 ). Исследования показали снижение активации комплемента и воспаления в покрытых по сравнению с непокрытыми трубками, тогда как другие не обнаружили разницы ( 32 , 33,35 ). Однако трубки с гепариновым покрытием обычно считаются более биосовместимыми и широко используются в экстракорпоральных контурах ( 34 ).
Давление 1 (c)
В МП давление создаётся потоком.
В физиологии человека давление в печеночной артерии (HA) аналогично давлению в аорте (±120 мм рт. ст.), тогда как давление в воротной вене (PV) составляет 6–10 мм рт. ст., а в полой вене (VC) — 2–4 мм рт. ст. ( 21 ). В НМП эти давления различаются между исследованиями: давление в HA составляет от 40 до 100 мм рт. ст., а давление в PV — от 5 до 18 мм рт. ст. ( 22 ).
Конюляция 1(d)
Можно выбрать канюлированную VC или нет. VC обычно имеет низкое давление, от 2 до 4 мм рт. ст., для создания градиента давления и улучшения однородного потока печени (21 ). Преимущество канюлированной VC заключается в улучшенной возможности точного мониторинга всех давлений и потоков, проходящих через печень (36 ). Однако недостатком является возможная обструкция и повышение давления внутри печени, вызывая отек или, наоборот, отрицательное давление внутри печени, когда насос опосредует отток ( 11 ,36 ). Преимущество неканюлированной VC заключается в том, что давление оттока в VC всегда низкое, но при этом доступно меньше мониторинга ( 11 ). При канюлированной VC всегда есть некоторая утечка из самой печени или сосудов, которую необходимо дренировать и возвращать в резервуар. Для этого часто требуется дополнительный (роликовый) насос ( 12 ). Кроме того, еще предстоит установить, требуется ли физиологическая трехфазная схема потока ВК для оптимизации перфузии печени во время МП ex situ
Поток 1(e)
Создаёт давление, может быть постоянный и пульсирующий.
В НМП давления различаются между исследованиями: давление в HA составляет от 40 до 100 мм рт. ст., а давление в PV — от 5 до 18 мм рт. ст. ( 22 ). Эти давления коррелируют с потоками в диапазоне от 100 до 450 и от 660 до 1500 мл/мин в HA и PV соответственно (22 ). Это сопоставимо с общей скоростью печеночного кровотока у взрослых людей, которая колеблется от 1500 до 1900 мл/мин в зависимости от веса печени, с соотношением артериального и воротного венозного кровотока 0,58 (21 ). Реакция печеночного артериального буфера также сохраняется в МП печени ex situ, что указывает на то, что регуляторная способность печеночной артерии производить компенсаторные изменения потока в ответ на изменения воротного венозного кровотока сохраняется (23 ). Из-за множества различий между экспериментами по перфузии трудно сказать, какие давления являются оптимальными. Однако в клинической МП сохраняется баланс между минимально возможными давлениями, чтобы избежать ненужного напряжения сдвига, в сочетании с достаточными скоростями потока для достижения адекватной и однородной перфузии.
Преимущества и недостатки пульсирующего и непрерывного потока в системах перфузии органов подробно изучались в течение десятилетий. В 1978 году Мавроудис (16 ) рассмотрел эту тему для аппаратов искусственного кровообращения, показав, что пульсирующий поток улучшает функцию почек, лимфоток и капиллярное кровообращение, снижая среднее артериальное давление, общее периферическое сопротивление и анаэробный клеточный метаболизм. После 1978 года исследования продолжились с использованием различных насосов и материалов. Однако до сих пор нет единого мнения о том, какой профиль потока является оптимальным. Некоторые исследования показывают сохраненную и улучшенную (микро)циркуляцию и более однородную перфузию с пульсирующим потоком, тогда как другие исследования искусственного кровообращения или изолированной перфузии органов не находят никаких различий между пульсирующим и непрерывным потоком ( 17 , 18 ). Поскольку пульсирующий артериальный поток более физиологичен и ряд исследований показывают превосходные результаты как в перфузии капиллярного русла, так и в более высоком потреблении O2 окружающей тканью, пульсирующий поток часто используется для артериальной стороны, а непрерывный поток — для портальной стороны.