1_ В дополнение к другим органам, ЭВМП сердца также требует модификаций аппаратной перфузионной системы, включая кабели для дефибрилляции или кардиостимуляции. В настоящее время в клинической практике используются две аппаратные системы перфузии сердца, включая Organ Care System™ Heart (TransMedics, Inc.) и Heart Box (XVIVO Perfusion).
Система Organ Care System™ Heart является портативной, использует NMP при температуре 34–37 °C и обеспечивает пульсирующий поток к трансплантату при перфузии раствором OCS, содержащим эритроциты и донорскую кровь. В 2015 году исследование не меньшей эффективности показало не меньшую эффективность по сравнению с сохранением SCS и открыло путь для клинического применения ( 34 ). Более того, клинические исследования показали, что OCS позволяет проводить трансплантацию сердца от доноров с расширенными критериями DBD ( 35 ) и DCD ( 36 , 37 ). В 2021 году одобрение FDA было получено на органы от доноров DBD, а совсем недавно и на органы DCD, что сделало его единственным устройством, одобренным FDA на данный момент.
Heart Box (XVIVO Perfusion), напротив, использует HMP при температуре 8°C и перфузирует сердце насыщенным кислородом раствором кардиоплегических питательных гормонов и ABO-совместимыми эритроцитами. Он портативен и обеспечивает непрерывный поток. Первое опубликованное исследование на людях продемонстрировало осуществимость и безопасность этого метода консервации при клинической трансплантации сердца ( 38 ), а также в многоцентровом клиническом исследовании, которое началось в 2020 году (NCT03991923). Следует отметить, что Heart Box совсем недавно использовался при первой ксеногенной ксенотрансплантации от свиньи к человеку ( 39 ).
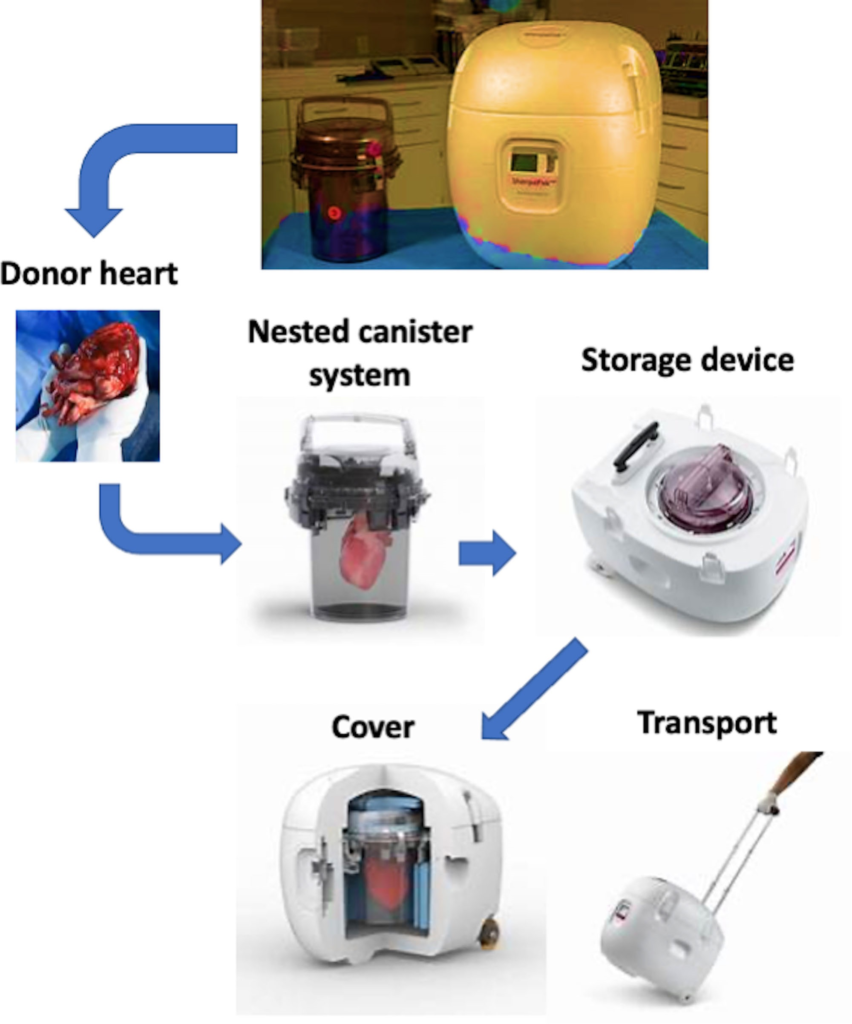
5_ SherpaPak не является перфузионным аппаратом, но обеспечивает равномерное охлаждение благодаря запатентованной технологии CoolSafe, способной поддерживать постоянную температуру 4–8°C. SherpaPak состоит из нескольких компонентов: 1) внешний транспортный контейнер, внутри которого находятся различные упаковочные элементы с контролируемой температурой на основе нониза, 2) внутренний и внешний узел жесткой оболочки, который образует жесткую барьерную оболочку, в которую погружено и подвешено сердце. решение для холодного хранения, разрешенное для использования при хранении и транспортировке донорских сердец, 3) регистратор данных, который контролирует и отображает температуру раствора для холодного хранения, в котором сердце хранится во время транспортировки, и 4) разъемы для сердца четырех размеров, предназначенные для размещения различных размер диаметра ствола аорты, к которому прикрепляются донорские сердца. На рисунке 3 представлены основные компоненты устройства. Система подвешивает донорское сердце в консервационном растворе для равномерного охлаждения в герметичной жесткой канистре с контролируемым давлением, которая обеспечивает постоянный температурный диапазон, предотвращает холодовые травмы и предлагает мониторинг в реальном времени и отчетность по данным. Предварительные результаты, полученные в 10 центрах по 569 пациентам (255 перевозок льдом и 314 перевозок ШерпаПаком) текущего ретроспективного/проспективного большого многоцентрового реестра (Глобальная база данных по использованию и регистрации для улучшенной сохранности сердца [GUARDIAN] Registry) 6 показали, что ранние клинические исходы, в том числе Показатели ПГД и продолжительность пребывания в отделении интенсивной терапии значительно улучшились в группе ШерпаПак.
На рисунке показано, как работает устройство Paragonix SherpaPak: сердце донора полностью подвешивается и погружается в консервирующий раствор во вложенную систему канистр; После установки ящик для хранения закрывается и устройство готово к транспортировке.
Сердечная транспортная система SherpaPerfusion представляет собой одноразовое устройство для гипотермической оксигенированной перфузии, сохранения и транспортировки трансплантата. Это устройство до сих пор не используется в клинической практике, но его опыт ограничен моделями на свиньях. В двух описанных доклинических условиях канюлю вводили в корень аорты и сердце соединяли с носителем органов шерпа, который был обработан раствором Цельсиора без крови. Донорское сердце было полностью погружено в раствор Цельсиора (ZA La Croix Grand Borne 69930 Saint-Laurent-de-Chamousset, France), который был помещен в оболочку Sherpa, которая обеспечивала второй, жесткий барьер для защиты донорского сердца. Затем эту сборку вставили в грузоотправитель Sherpa, что создало однородную охлаждающую среду. Для работы устройства в исследовательском режиме система SherpaPerfusion была оснащена несколькими датчиками давления и температуры. Перфузия органов достигалась путем циклического повышения давления в двух камерах: крышке и контейнере для органов, соединенных через порт, через который раствор поступает в корень аорты. Перфузионное давление ~3 мм рт.ст., коронарный кровоток ~44 мм рт.ст., парциальное давление кислорода (pO2 ) в растворе корня аорты ~300 мм рт.ст. При анализе на аппарате для реперфузии in vitro сердца, собранные с помощью SherpaPerfusion, показали меньшую микроскопическую эндотелиальную дисфункцию и меньшее повреждение клеток миокарда. Однако никаких различий в функциях обнаружено не было, а у SherpaPerfusion наблюдался больший вес сердца (отек). Необходимы дальнейшие более масштабные исследования на людях по сравнению с доступными в настоящее время альтернативными устройствами, чтобы проверить, какое устройство может достичь наилучших результатов с точки зрения дисфункции трансплантата, отторжения сердца и выживания.
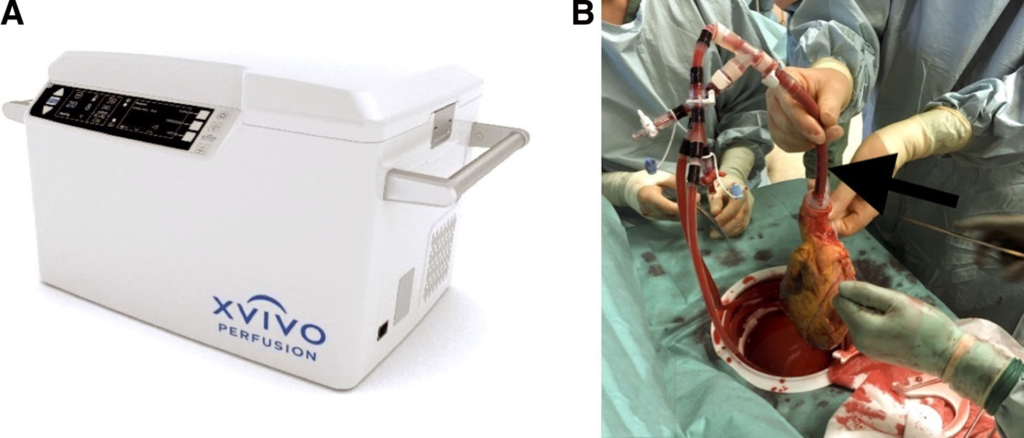
Система XVIVO NIHP — это портативное устройство, одобренное для наземной и воздушной транспортировки ( рис. 4А ). Сердце непрерывно перфузируется холодным (8°C) кислородсодержащим кардиоплегическим раствором питательных гормонов, содержащим эритроциты из банка крови.
Рисунок 4.:Гипотермическая аппаратная перфузионная система – аппарат XVIVO.
А : аппарат для внешней перфузии XVIVO;
B : изображение, показывающее, как выглядит сердце после извлечения из аппарата для имплантации (черная стрелка показывает аортальную канюлю, которая отвечает за перфузию аорты во время транспортировки).
Оборудование состоит из резервуара, роликового насоса с регулируемым давлением, оксигенатора, артериально-лейкоцитарного фильтра, нагревательно-охладительного блока, баллонов с кислородом и углекислым газом, газового смесителя, датчиков и программируемой системы управления. Резервуар заполняется 2,5 л перфузионного раствора плюс ~500 мл совместимых облученных клеток крови и клеток крови с пониженным содержанием лейкоцитов, что обеспечивает гематокрит ~15%. Перфузия осуществляется через аортальную канюлю в коронарные сосуды. Технически донорское сердце арестовывают сердечно-консервирующим раствором без эритроцитов (1200 мл). Затем сердце донора собирают с использованием той же процедуры, что и для группы SCS. После этого дистальную восходящую аорту канюлируют из устройства с помощью специальной двухпросветной канюли для облегчения удаления воздуха, а в левый желудочек через предсердие вводят мягкую силиконовую трубку диаметром 3/8 дюйма для поддержания желудочка в декомпрессированном состоянии. Полые вены и легочную артерию оставляют открытыми для свободного выхода перфузата из коронарного синуса. Двухпросветную канюлю, снабжающую аорту консервирующей средой, фиксируют в вертикальном положении и сердце погружают в раствор для консервации сердца, который активно регулируется для поддержания рН ~7,4 и температуры 8°C. Программное обеспечение устройства настроено на поддержание среднего артериального давления 20 мм рт. ст. в корне аорты, обеспечивая прерывистый коронарный поток от 150 до 250 мл/мин. После эксплантации сердца реципиента непрерывную перфузию переключают на прерывистую. Во время имплантации сердца аортальная канюля удерживается в корне аорты, тем самым обеспечивая стабильность сердца ( рис. 4В ). Во время процедуры имплантации через канюлю вводили периодическую перфузию 200–300 мл консервирующего раствора во избежание ишемии. Канюлю извлекали перед наложением аортального анастомоза. Образцы крови были взяты из коронарного синуса правого предсердия.
Текущие клинические данные основаны на нерандомизированном исследовании фазы II, в котором 25 пациентов были распределены на SCS и 6 на XVIVO NIHP 29 : предварительные результаты подтвердили осуществимость и безопасность устройства XVIVO NIHP для клинического использования при трансплантации сердца. Рандомизированное клиническое многоцентровое исследование с участием различных европейских центров продолжается и имеет целью оценить раннюю и 1-летнюю смертность и дисфункцию трансплантата между рандомизированными сердцами, полученными с помощью устройства XVIVO, по сравнению с сердцами, транспортированными с помощью SCS. Эта технология была использована для сохранения органов при первой ксенотрансплантации сердца у человека. 30